簡介
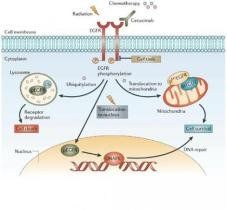
EGFR(Epidermal Growth Factor Receptor)是上皮生長因子(EGF)細胞增殖和信號傳導的受體。EGFR屬於ErbB受體家族的一種,該家族包括EGFR (ErbB-1),HER2/c-neu(ErbB-2),Her 3(ErbB-3) 和Her 4(ErbB-4)。EGFR也被稱作HER1、ErbB1,突變或過表達一般會引發腫瘤。EGFR是一種糖蛋白,屬於酪氨酸激酶型受體,細胞膜貫通,分子量170KDa。EGFR位於細胞膜表面,靠與配體結合來激活,包括EGF和TGFα(transforming growth factor α)。激活後,EGFR由單體轉化為二聚體,儘管也有證據表明,激活前也存在二聚體。EGFR還可能和ErbB受體家族的其他成員聚合來激活,例如ErbB2/Her2/neu。
EGFR二聚後可以激活它位於細胞內的激酶通路,包括Y992, Y1045, Y1068, Y1148 and Y1173等激活位點。 這個自磷酸化可以引導下游的磷酸化,包括MPAK,Akt和JNK通路, 誘導細胞增殖。受體激活對於皮膚的免疫來說很重要。
研究表明在許多實體腫瘤中存在EGFR的高表達或異常表達。EGFR與腫瘤細胞的增殖、血管生成、腫瘤侵襲、轉移及細胞凋亡的抑制有關。其可能機制有:EGFR的高表達引起下游信號傳導的增強;突變型EGFR受體或配體表達的增加導致EGFR的持續活化;自分泌環的作用增強;受體下調機制的破壞;異常信號傳導通路的激活等。EGFR的過表達在惡性腫瘤的演進中起重要作用,膠質細胞、腎癌、肺癌、前列腺癌、胰腺癌、乳腺癌等組織中都有EGFR的過表達。對膠質細胞瘤的研究發現EGFR的高表達主要與其基因擴增有關。但有時EGFR表達水平的調節異常也存在於翻譯及翻譯後。EGFR在腫瘤中的高表達還可能與活化後降解減少有關,一些研究指出c-Src可通過抑制受體泛素化和內吞作用而上調EGFR水平。許多腫瘤中有突變型EGFR存在,現已發現許多種EGFR突變型。突變型EGFR的作用可能包括:具有配體非依賴型受體的細胞持續活化;由於EGFR的某些結構域缺失而導致受體下調機制的破壞、異常信號傳導通路的激活、細胞凋亡的抑制等。突變體的產生是由於EGFR基因的缺失、突變和重排。EGFR的配體對細胞內信號傳導有很大影響。EGFR的配體通過自分泌形式激活EGFR促進細胞增殖,他們的共表達往往預示腫瘤預後不良,例如,在乳腺浸潤性導管癌的研究中發現,TGFα與EGFR共表達,且這種共表達與病人的生存率顯著相關。Kopp等人對結/直腸癌的研究表明腫瘤的自分泌生長是EGFR的過表達及其配體表達共同作用的結果。
此外,對EGFR與腫瘤的血管生成、高侵襲性及轉移關係的研究發現EGFR可以通過Ang-1及VEGF等因子水平的調節而影響腫瘤血管生成。
作用
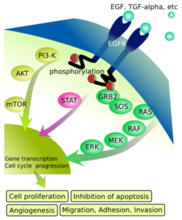
在配體與表皮生長因子受體(EGFR)結合後,受體發生了二聚作用,二聚作用既包括兩個同種受體分子的結合(同源性二聚作用),也包括人類EGF相關性受體(HER)酪氨酸激酶家族中的不同成員的結合(異源性二聚作用)。 二聚作用後是酪氨酸殘基的自磷酸化作用。這些磷酸化的殘基是募集適配蛋白和額外的酪氨酸激酶底物的結合位點。蛋白質在激活的受體複合物中相互作用刺激ras蛋白,導致磷酸化級聯反應的發生和絲裂原激活蛋白(MAP)激酶的激活。或者轉錄信號傳導和激活、磷脂醯肌醇激酶-3(PI3K)-Akt和應激活化蛋白激酶(SAPK)信號傳導通路將被激活。這些信號通路依次觸發基因轉錄,同時控制細胞增生、分化和生存的通路被激活。
 EGFR
EGFREGFR介導信號通路的特異性和強度取決於激活蛋白的性質和四種EGFR家族成員的水平。與HER2結合的配體不詳,但當HER2和EGFR共表達時,前者經常與配體激活的後者結合形成二聚體。這種異源性二聚體與EGFR同源性二聚體相比,往往具有更高的再利用率、穩定性和傳導信號的能力。EGFR也能與HER3和HER4發生二聚作用,其產物具有更高的持久性和更強的PI3K活性。EGFR信號傳導通路一旦配體結合的EGFR被內吞入細胞,信號將終止,受體將被降解或再循環到細胞膜表面,這取決於配體的性質。例如,EGF結合的受體將被降解,而TGF-α結合的受體則進入再循環。不同的生長因子會影響EGFR信號通路的數量和持續時間。
EGFR信號通路有多重的生物學作用。例如,ras-MAPK信號轉導通路刺激細胞的分裂和遷徙。EGFR也是多種受體通路的重要介體,起到信號會聚點的作用,能夠將信號整和與多樣化。例如,在應激、膜解聚作用和一些非生理性刺激物(包括氧化劑、放射線和烷化劑)的反應中,反向激活能誘導EGFR酪氨酸激酶的磷酸化並隨後發生信號的轉導。EGFR家族的成員在正常發育中起了重要的作用,但在人類腫瘤中經常過度表達並失去控制。
相關
EGFR和KRAS基因檢測
EGFR表達於正常上皮細胞表面,而在一些腫瘤細胞中常過表達,EGFR的過表達和腫瘤細胞的轉移、侵潤、預後差有關。EGFR下游的信號轉導通路主要有兩條:一條是Ras/ Raf/ MEK/ERK-MAPK 通路,而另一條是PI3K/Akt/mTOR通路。
EGFR突變:EGFR酪氨酸激酶區域的突變主要發生在18-21外顯子,其中19和21號外顯子突變復蓋突變的 90%。
KRAS基因檢測
KRAS蛋白處於EGFR信號通路通路的下游。在正常生理情況下,EGFR信號通路被活化後,KRAS蛋白短暫激活,其後迅速失活,KRAS激活/失活效應是受控的。而KRAS基因突變時,可以導致EGRF信號通路持續激活,加速腫瘤細胞增殖。KRAS基因突變96%發生在第2號外顯子的12、13號密碼子。20% 非小細胞肺癌(NSCLC)、30-35%大腸癌患者中存在KRAS基因突變。
KRAS基因檢測的重要性
K-ras基因可以是正常狀態(稱為野生型)或異常狀態(突變型)。 K-ras突變型編碼異常的蛋白,刺激促進惡性腫瘤細胞的 生長和擴散;並且不受上游EGFR的信號影響,所以對抗EGFR治療效果差。KRAS基因檢測可以篩選出EGFR靶向治療藥物有效的大腸癌患者,幫助醫生選擇對腫瘤病人最有效的治療方法,實現腫瘤病人的個體化治療。目前在歐美國家,大腸癌患者內科治療前已經常規檢測KRAS狀態,並且成為能否報銷相關抗EGFR治療費用的憑據。
K-ras基因突變發生的時間 K-ras基因突變發生在腫瘤惡變的早期,並且原發灶和轉移灶的K-ras基因高度保持一致。一般認為,K-ras基因狀態不會因治療而發生變化。大腸癌患者K-ras基因突變異常的機率為30%-35%。
 EGFR
EGFRK-ras基因檢測臨床意義 檢測K-ras基因突變是深入了解癌基因的情況、了解各種癌症的發展預後、放化療療 效的重要指標。
eGFR公式評價與選擇
正確理解eGFR公式
腎小球濾過率(GFR)是慢性腎臟病(CKD)診斷和分期所依據的重要功能指標。它不能直接測量,只能用某些物質的腎臟或血漿清除率表示。
臨床常用內生肌酐清除率(Ccr)估算GFR,但測量Ccr操作繁瑣,影響因素多,易出偏差。數十年前臨床學者即開始嘗試開發含肌酐及性別、年齡、身高和體重等因素的GFR估算值(eGFR)公式。
eGFR公式為CKD分期提供了極大便利,但其缺陷促使人們不斷對其進行完善。最近發布的美國腎臟病膳食改良實驗(MDRD)公式和慢性腎臟病流行病學合作(CKD-EPI)公式就是努力的結果。
在MDRD公式本土化過程中,我國和日本為公式添加的種族係數分別為1.23和0.8。同是黃種人,為何有如此大的差異?是否有種族之外的影響因素?我國和日本腎病學者已開始共同探討這一話題。
為此,北京大學第一醫院左力教授闡述了eGFR公式開發歷程,並就種族係數的差異性進行評說,希望能幫助讀者正確理解eGFR公式。
MDRD公式套用
發表於1999年的MDRD原始公式用苦味酸法測量肌酐,用接近GFR真值的碘(125I)海醇腎臟清除率作為GFR參考值(rGFR)。用於開發公式的1628例患者平均肌酐2.3 mg/dl,rGFR 39.8 ml/(min・1.73m2)。經檢測,該公式在美國人群中的準確性和精確性優於既往eGFR公式,獲得腎臟病預後生存指南(K/DOQI)的推薦。
為提高準確性,研究者於2006年用更準確的同位素稀釋質譜法(IDMS-Traceable)重新測量上述1628例患者的血肌酐水平,將重新表達的MDRD公式用於美國國家健康和營養調查研究(NHANES)人群,得到eGFR<60 ml/(min・1.73m2)患病率為8.1%。
大量研究證實,上述公式用於GFR正常或接近正常的人群時,所得eGFR將低於rGFR。
2009年研究者將樣本量擴大到8254例,平均rGFR 68 ml/(min・1.73m2),平均肌酐1.7 mg/dl,用IDMS-Traceable法測定肌酐,再次修訂eGFR公式,得到CKD-EPI公式。該公式用於NHANES人群,得到eGFR<60 ml/(min・1.73m2)的患病率為6.7%。
eGFR協作組對公式的改良
由北京大學第一醫院腎內科牽頭的我國9個腎臟病中心組成eGFR協作組,於2005年對MDRD原始公式進行檢驗,發現當rGFR接近正常或較低時,MDRD公式會較rGFR偏低或偏高。
2006年,協作組納入684例CKD患者,通過添加種族係數對MDRD原始公式進行本土化。研究採用雙血漿法鎝(99mTc)-dtpa血漿清除率作為rGFR,患者平均rGFR 55 ml/(min・1.73m2);用苦味酸法測定血漿肌酐,通過線性回歸將肌酐標準化為MDRD肌酐,回歸斜率1.3,即將eGFR協作組肌酐乘以1.3轉化為MDRD肌酐,決定係數為0.999。將標準化肌酐水平(平均2.0 mg/dl)、患者性別和年齡代入MDRD原始公式計算eGFR,以eGFR為自變數、rGFR為因變數進行線性回歸,確定種族係數為1.23。協作組還公布了與MDRD原始公式形式相同、無種族係數的eGFR公式:eGFR=175×[肌酐(mg/dl)]-1.234 ×[年齡(歲)]-0.179 ×性別(男性=1,女性=0.79)。用其得到北京市人群eGFR< 60 ml/(min・1.73m2)患病率為1.7%。
日本eGFR公式變化過程
2007年,日本學者開發了適合其民族的eGFR公式。該公式來自248例CKD患者,使用IDMS-Traceable肌酐方法並校準到MDRD研究方法。患者來自兩組研究,平均血肌酐水平分別為1.83 mg/dl和1.28 mg/dl,使用菊粉清除率作為rGFR。同樣通過為MDRD原始公式添加種族係數的方法,得到的種族係數為0.88。該公式估算日本人群eGFR<60 ml/(min・1.73m2)患病率為20%。
2009年,日本學者將樣本量擴大到413例,對種族係數進行調整。肌酐方法和rGFR方法不變,入選患者平均rGFR 59 ml/(min・1.73m2),平均肌酐1.6 mg/dl,調整後的種族係數為0.80。
美、中、日eGFR相關研究啟示
中國和日本為MDRD公式添加的種族係數分別為1.23和0.80。同為黃種人,為何差異如此之大?
當建立線性回歸模型時,我們假設變數呈線性相關。如果一個變數的變化完全可以用另一變數的變化來解釋,則此回歸分析決定係數為1。通常臨床研究不可能達到如此精度。
在上述種族係數調整建模過程中,實際作了如下假設:rGFR= MDRD× 種族係數 + 隨機誤差。據此,若用MDRD原始公式計算出的eGFR與rGFR之間無系統差異,則全部為隨機誤差,種族係數是1;若兩者間有系統差異,則該差異只能由種族係數承擔,儘管理想的種族係數是“種族差異”(可能包括身體構成、飲食差異、甚至基因方面差異),而非其他原因導致的系統誤差。
在計算種族係數時,以下因素可能導致偏大或偏小。
rGFR的系統差異 MDRD研究使用碘海醇皮下注射,計算4個時段平均rGFR;我國採用雙血漿法99mTc-DTPA血漿清除率;日本採用持續靜脈點滴菊粉,計算3個時段菊粉清除率均值。
這三種rGFR存在系統差異:CKD-EPI公式計算的人群平均rGFR為68 ml/(min・1.73m2),平均肌酐1.7 mg/dl;日本平均rGFR 59 ml/(min・1.73m2),平均肌酐1.6 mg/dl。日本的平均肌酐比美國低0.1 mg/dl,而相應rGFR卻也低9 ml/(min・1.73m2)。由於日本血肌酐是跟MDRD研究校準過的,這種rGFR之間的差異只能用rGFR系統偏差來解釋。日本rGFR偏低,當然計算的種族係數<1.0。
肌酐方法的系統差異 我國和日本的肌酐都校準到MDRD研究的方法,但需要把我國的肌酐乘以1.3才能轉化為MDRD肌酐值。若eGFR協作組測定的肌酐為3.0 mg/dl,轉變為MDRD肌酐就成了3.9 mg/dl。這個巨大的系統誤差使人聯想到是否存在因校準帶來系統誤差,例如標本轉運、凍融、測量過程等。
如果用在中國國內測量的肌酐值直接套入加中國係數的MDRD方程,得到的eGFR高於GFR真值。如果使用加種族係數的方程,則首先需把肌酐校準到MDRD研究的方法,可直接將肌酐乘以1.3,再套用加種族係數的方程。我們不建議這樣做,實際上直接使用公式eGFR=175×[肌酐(mg/dl)]-1.234×[年齡(歲)]-0.179× 性別(男性=1,女性=0.79)更方便。由於不同實驗室存在系統誤差,如果用該公式進行人群研究,建議首先將肌酐水平校準到eGFR協作組方法,否則獲得的eGFR下降患病率差異較大。但如果將公式用於個體患者和臨床決策,就沒有必要進行這種複雜校準。
rGFR分布的系統差異 原始MDRD研究的rGFR平均值為39.8 ml/(min・1.73m2),據此NHANES的eGFR降低患病率為8.1%;CKD-EPI研究rGFR均值為68 ml/(min・1.73m2),據此NHANES的eGFR降低患病率為6.7%。這說明用於研發公式的患者rGFR分布對eGFR公式的最終形式有很大影響。當rGFR包含早期CKD或健康者較少時,研發的公式不適用於健康人群。MDRD公式和日本修訂公式的rGFR均包含較少的早期CKD患者,日本公式甚至還包含急性腎衰竭患者。因此用於社區人群調查時,eGFR <60 ml/(min・1.73m2)患病率將被高估。
rGFR分布差異導致的公式形式差異不但影響對人群eGFR降低患病率的估計,也會導致種族係數偏差。
如何使eGFR更接近真值是個難題,需要證實不同的rGFR是否有系統差異,並計算其大小。另外,在用肌酐估計eGFR公式時,是否存在“真正的”種族係數、種族係數是多少。