成份
 特羅凱
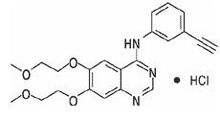
特羅凱本品主要成份為鹽酸厄洛替尼,其化學名稱為:
N-(3-乙炔苯基)-6,7-雙(2-甲氧乙氧基)-4-喹啉胺鹽酸鹽
其結構式為:
分子式:CHNO•HCl
分子量:429.90
性狀
100mg 片劑:圓形、雙凸、白色包衣片,一面印有灰色“Tarceva”、“100”和特羅凱標識,另一面空白。
150mg 片劑:圓形、雙凸、白色包衣片,一面印有棕色“Tarceva”、“150”和特羅凱標識,另一面空白。
適應症
厄洛替尼單藥適用於既往接受過至少一個化療方案失敗後的局部晚期或轉移的非小細胞肺癌(NSCLC)。
兩項多中心、隨機、安慰劑對照的Ⅲ期試驗中,結果顯示厄洛替尼聯合含鉑化療方案(卡鉑+紫杉醇;或者吉西他濱+順鉑)作為局部晚期或轉移的NSCLC 患者一線治療,相對單用含鉑化療未增加臨床獲益,因此不推薦用於上述情況的一線治療。
厄洛替尼單藥可用於經4 個周期以鉑類為基礎的一線化療後處於疾病穩定的局部晚期或轉移的非小細胞肺癌患者的維持治療。該適應症是基於一項隨機、雙盲、安慰劑對照研究(BO18192)結果[見【臨床試驗】]。目前尚未獲得比較一線化療後未進展和進展後使用厄洛替尼治療的臨床研究數據。
本品用於EGFR 突變人群一線治療的臨床研究正在進行中。建議經治醫生根據本品和同類藥物研究進展以及患者自身狀況綜合考慮適宜的治療選擇。
規格
(1)100 毫克
(2)150 毫克
(3)150毫克
用法用量
本品必須在有此類藥物使用經驗的醫生指導下使用。
厄洛替尼單藥用於非小細胞肺癌的推薦劑量為150mg/日,至少在進食前1小時或進食後2小時服用。持續用藥直到疾病進展或出現不能耐受的毒性反應。無證據表明進展後繼續治療能使患者受益。
劑量調整
患者出現新的急性發作或進行性的肺部症狀,如呼吸困難、咳嗽和發熱,應暫停厄洛替尼治療進行診斷評估。如果確診是ILD(間質性肺病),則應停用厄洛替尼,並給予適當的治療(參見【注意事項】警告-肺臟毒性)。
腹瀉通常可用洛哌丁胺控制。嚴重腹瀉洛哌丁胺無效或出現脫水的患者需要劑量減量和暫時停止治療。嚴重皮膚反應的患者也需要劑量減量和暫時停止治療。
如果必須減量,厄洛替尼應該每次減少50mg。
同時使用CYP3A4強抑制劑如阿扎那韋、克拉黴素、印地那韋、伊曲康唑、酮康唑、奈法唑酮、奈非那韋、利托那韋、沙奎那韋、泰利黴素、醋竹桃黴素(TAO)和伏立康唑等藥物時應考慮劑量減量,否則可出現嚴重的不良事件。
治療前使用CYP3A4誘導劑利福平可減少厄洛替尼 AUC的2/3。應考慮使用無CYP3A4誘導活性的其他可替代治療。如果沒有可替代的治療,應考慮高於150mg的厄洛替尼的劑量。如果厄洛替尼的劑量上調了,則停止利福平或其他誘導劑時劑量應減少。其他CYP3A4誘導劑包括但不限於利福布汀、利福噴丁、苯妥英、卡馬西平、苯巴比妥和聖約翰草,如果可能也應避免使用這些藥物(參見【注意事項】和【藥物相互作用】)。
厄洛替尼的清除在肝臟代謝和膽道分泌。因此厄洛替尼應慎用於肝臟功能障礙的患者。如果出現嚴重的不良反應應考慮厄洛替尼減量或暫停(參見【藥代動力學】特殊人群-肝功能異常患者,【注意事項】肝功能異常患者和【不良反應】)。
尚未進行腎損傷患者(血清肌酐濃度]1.5 x ULN)的療效和安全性研究。基於藥代動力學數據,輕度或中度腎損傷患者不需要劑量調整(參見【藥代動力學】)。不推薦嚴重腎損傷患者使用厄洛替尼。
已證實吸菸會導致厄洛替尼暴露量降低50-60%。吸菸NSCLC 患者的厄洛替尼最大耐受劑量為300mg。給予繼續吸菸患者高於推薦起始劑量厄洛替尼的療效和長期安全性(]14天)尚未確證(參見【藥物相互作用】和【藥代動力學】特殊人群)。若厄洛替尼用量已提高,患者停止吸菸後應立即減少至批准的起始劑量(參見【藥代動力學】)。
不良反應
 特羅凱
特羅凱由於臨床試驗進行的條件有很大不同,因此無法直接將一個藥物臨床試驗與另一個藥物臨床試驗中的不良反應發生率進行比較,也可能無法反映臨床實踐中觀察到的發生率。
厄洛替尼的安全性評估是基於1200 多例至少接受過一次150mg 厄洛替尼單藥治療患者的數據和300 多例接受過厄洛替尼100mg 或150mg 聯合吉西他濱治療患者的數據,以及1228例接受厄洛替尼聯合化療患者的數據。
來自於臨床試驗中厄洛替尼單藥或聯合化療報告的不良反應(ADR)總結如下。下表所列ADR 是發生率至少10%(厄洛替尼組)且較對照組高(³3%)的不良反應。
服用厄洛替尼治療NSCLC、胰腺癌和其它晚期實體腫瘤的患者中有報告嚴重的不良反應,包括致命的事件(參見【注意事項】警告-肺毒性和【用法用量】劑量調整)。
厄洛替尼單藥
NSCLC維持治療
一項雙盲、隨機、安慰劑對照的III 期研究(BO18192)中,889 例復發或轉移的晚期NSCLC 患者接受一線標準鉑類為基礎的化療後接受厄洛替尼150mg 每天一次或安慰劑治療,持續直至出現疾病進展、不可接受的毒性或死亡事件為止。厄洛替尼治療組報告的最頻繁的不良反應為皮疹和腹瀉(所有級別,分別為49%和20%),大多數為I/II 級,可控制的,無須干預治療。III 級的皮疹和腹瀉分別為6% 和1.8%。沒有觀察到IV 級的皮疹或腹瀉。因為皮疹和腹瀉導致厄洛替尼停藥的的患者百分比分別為1% 和[1%。因為皮疹和腹瀉需要進行劑量調整(中斷或減量)的患者百分比8.3%和3%。在發生皮疹的厄洛替尼治療患者中,兩周內發生皮疹者占66%,在一個月內發生者占81%。
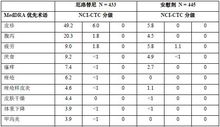
表 1 按國立癌症研究所通用毒性反應標準(NCI-CTC)3.0 版分級總結了維持治療試驗中,厄洛替尼單藥(150 mg)治療組發生率較安慰劑組高3%且發生率≥3%的不良反應,不考慮因果關係。
表1 維持治療研究中厄洛替尼單藥治療組發生率較安慰劑組高(≥3%)且發生率≥3%的不良反應
在維持治療研究中,接受厄洛替尼單藥治療的患者出現了肝功能檢查異常(包括丙氨酸轉氨酶(ALT)、天冬氨酸轉氨酶(AST)和膽紅素升高)。厄洛替尼組和安慰劑組治療患者發生2 級(]2.5 – 5.0 x ULN) ALT 升高的患者分別占2%和1%,3 級(]5.0 – 20.0 x ULN) ALT升高的患者分別占1%和0%。厄洛替尼治療組出現2 級(]1.5-3.0 x ULN)和3 級 (]3.0-10.0 x
ULN)膽紅素升高的患者分別占4%和[1%,與之相比,這兩事件在安慰劑組均[1%。若肝功能出現嚴重變化,則應中斷或停止厄洛替尼給藥(參見【用法用量】)。
NSCLC二/三線治療
一項隨機、雙盲、安慰劑對照的III 期研究(BR.21)中,731 例既往至少一個化療方案失敗的局部晚期或轉移性NSCLC 患者按2:1 的比例隨機接受每日一次口服厄洛替尼150mg或者安慰劑治療,直到疾病進展或有不能接受的毒性反應。該研究中報告的不良反應見表2。
最常見的不良反應是皮疹(75%)和腹瀉(54%)。程度多為I 級或II 級,無需干預即可獲得控制。厄洛替尼治療的患者III/IV 級皮疹和腹瀉發生率分別為9%和6%。厄洛替尼治療的患者因皮疹或腹瀉而終止試驗的比例均為1%。分別有6%和1%的患者因皮疹和腹瀉需要減量。BR.21 中出現皮疹的中位時間為8 天,出現腹瀉的中位時間為12 天。
表2 BR.21研究中厄洛替尼組發生率較安慰劑組高(≥3%)且發生率≥10%的不良反
厄洛替尼150mg 單藥治療的NSCLC 患者中可觀察到肝功能檢查異常(包括谷丙轉氨酶(ALT)、穀草轉氨酶(AST)和膽紅素升高)。升高主要為一過性或與肝臟轉移有關。厄洛替尼和安慰劑治療患者出現II 級ALT 升高(]2.5-5.0 倍正常上限)分別為4%和[1%。厄洛替尼治療患者中未出現III 級ALT 升高(]5.0-20.0 倍正常上限)。肝功能異常嚴重時要考慮
劑量減量或暫停治療(參見【用法用量】劑量調整)。
在一項厄洛替尼單藥治療晚期NSCLC 的單組、非對照國際多中心臨床研究(TRUST)的中期分析中,總結了6578 例患者的安全性數據,結果沒有發現新的安全性信號。厄洛替尼治療相關的皮疹發生率為71%,其中III/IV 級皮疹為12%。厄洛替尼嚴重不良反應的發生率為4%。有5%的患者因不能耐受不良反應而提前終止厄洛替尼治療;在509 例入選的中國患者中,皮疹發生率為84%,III/IV 級皮疹的發生率為4%。僅3 例([1%)患者出現厄洛替尼治療治療相關的嚴重不良反應。6 例(1%)患者因不良反應提前了終止厄洛替尼治療。
厄洛替尼聯合化療
一項對照臨床試驗(PA.3)中,569 例局部晚期不可手術切除的或轉移性胰腺癌患者按1:1 比例隨機接受厄洛替尼(100 mg 或 150 mg) 或安慰劑聯合吉西他濱IV(1000 mg/m2,周期1——第1, 8, 15, 22, 29, 36 和43 天給藥,8 周為一周期;周期2 及以後周期中,第 1, 8和15 天給藥,4 周為一周期)。厄洛替尼每日口服直至疾病進展或不可接受的毒性。主要終
點是生存期,次要終點是緩解率和無進展生存期。緩解時間也予以觀察。共285 例患者接受厄洛替尼聯合吉西他濱治療(261 例患者在100mg 組,24 例患者在150mg 組),284 例患者接受吉西他濱加安慰劑治療(260 例患者在100mg 組,24 例患者在150mg 組)。接受150mg厄洛替尼治療的患者過少,不足以得出任何結論。
接受100mg 厄洛替尼+吉西他濱治療的胰腺癌患者中最常見的不良反應是乏力、皮疹、噁心、食欲不振和腹瀉。在厄洛替尼+吉西他濱治療組中,接受治療患者III/IV 級皮疹和腹瀉的發生率各為5%,中位發生時間分別為10 天和15 天,各導致2%的患者進行減量治療,不超過1%的患者停藥。
150mg 組(23 例)中特定的一些不良反應,包括皮疹的發生率更高,以至減量或者停藥更加頻繁。
表 3 列出了胰腺癌患者的隨機臨床試驗中,不考慮因果關係,100mg 厄洛替尼+吉西他濱治療組患者中發生率≥10%的不良反應,按照NCI-CTC 進行分級。
表3 100mg厄洛替尼+吉西他濱治療的胰腺癌患者中發生率≥10%的不良反應
在胰腺癌臨床試驗中,在厄洛替尼/吉西他濱組中10 例患者發生深靜脈血栓(發生率為3.9%)。相比之下,在安慰劑/吉西他濱組中3 例患者發生深靜脈血栓(發生率為1.2%)。III級或IV 級血栓事件,包括深靜脈血栓的總體發生率在兩個治療組中類似:厄洛替尼+吉西他濱組為11%,安慰劑+吉西他濱組為9%。
厄洛替尼+吉西他濱組與安慰劑+吉西他濱組相比,III 級或IV 級血液學實驗室毒性未見差異。
在厄洛替尼+吉西他濱組中發生率在5%以下的嚴重不良反應(≥ NCI-CTC III 級)包括昏厥、心律不齊、腸梗阻、胰腺炎、溶血性貧血包括血小板減少引起的微血管溶血性貧血、心肌梗塞/心肌缺血、腦血管意外包括腦出血以及腎功能不全(見【注意事項】警告)。
接受厄洛替尼+吉西他濱治療的胰腺癌患者中觀察到肝功能檢查異常(包括ALT、AST和膽紅素升高)。表4 中列出了發生的NCI-CTC 最嚴重級別的肝功能異常。如果肝功能變化嚴重的話,應該考慮減少厄洛替尼的用量或者停藥(見【用法用量】劑量調整部分)。
表4:胰腺癌患者的肝功能檢查異常(最嚴重NCI-CTC分級):100mg
組其他的觀察資料(基於所有的臨床研究數據)
以下的不良反應是在接受厄洛替尼 150mg 單藥治療或者厄洛替尼100mg 或150mg 與吉西他濱聯合治療的患者中觀察到的。
以下的術語用於對不良反應的發生率進行分級:非常常見(≥1/10);常見(≥1/100, [1/10);不常見(≥1/1,000, [1/100);罕見(≥1/10,000, [1/1000);非常罕見([1/10,000),包括單個報告。
非常常見的不良反應見表1、表2 和表3,其他頻率的不良反應分類總結如下。
胃腸道異常:
厄洛替尼治療組有胃腸道穿孔報告,但不常見(少於1%),部分病例產生致命的後果(見【注意事項】)。
消化道出血的病例報導常見(包括部分死亡病例),一些與同時服用華法林有關(參見【注意事項】國際標準化比值(INR)升高和出血可能部分)。這些報導包括消化器官潰瘍出血(胃炎、胃與十二指腸潰瘍)、嘔血、便血、黑糞症以及可能的結腸炎出血(見【注意事項】)。
腎功能異常
有報告急性腎衰竭或腎功能不全,包括死亡,伴有或不伴有低血鉀症(見【注意事項】)。
肝功能異常
厄洛替尼的臨床試驗中經常觀察到肝功能檢查異常(包括ALT、AST、膽紅素升高),PA3 研究中尤其常見。大部分為輕到中度,呈一過性或與肝轉移有關。厄洛替尼使用期間報告了肝功能衰竭(包括死亡)的罕見病例。混雜因素包括先前存在的肝臟疾病或合用肝毒性藥物。
眼疾
接受厄洛替尼治療的患者有非常罕見的角膜潰瘍或穿孔的報告。
角膜炎和結膜炎在厄洛替尼治療中經常發生。睫毛生長異常包括:睫毛向內生長、過度生長和睫毛變粗等(見【注意事項】)。
呼吸道、胸部和縱隔異常
厄洛替尼治療NSCLC 和其他進展性實體瘤時,有報導患者發生嚴重的間質性肺病(ILD 樣事件包括死亡)(見注意事項)。
鼻衄在NSCLC 和胰腺癌試驗中均有報導。
皮膚和皮下組織異常
接受厄洛替尼治療患者最常報告的不良反應為皮疹,一般表現為輕到中度的紅斑和膿皰性丘疹,多發生或加重於身體陽光暴露部位。對於要暴露在陽光下的患者,建議穿上保護性的衣服,和/或使用防曬霜(例如含礦物質)。皮膚開裂報導常見,多不嚴重,大部分與皮疹和皮膚乾燥有關。其它輕度的皮膚反應如色素沉著也有觀察到,但不常見(少於1%)。
已有大皰性,水泡性和剝脫性皮膚改變的報告,包括非常罕見的Stevens-Johnson 綜合徵/中毒性表皮壞死松解症,有些情況下是致命的(見【注意事項】)。
臨床試驗中有報導其它頭髮和指甲變化,通常不嚴重,例如,常見甲溝炎,罕見睫毛/眉毛變化以及脆甲和松甲。
總體上,無論是單藥治療還是與吉西他濱聯合使用,厄洛替尼的安全性在女性與男性之間以及年輕人與65 歲以上老年人之間無顯著差別,在白種人和亞洲患者之間也無差別(參見【注意事項】和【老年用藥】)。
上市後經驗
在厄洛替尼上市後觀察到以下不良反應。因為這些不良反應來自不確定的樣本量的自發報告,故不能可靠的估計其發生頻率和藥物的因果關係。
皮膚和皮下組織異常:
頭髮和指甲變化,通常不嚴重,上市後監測中罕有報告,例如,多毛症、睫毛/眉毛變化、甲溝炎以及脆甲和松甲。
大皰、起泡、表皮剝落等皮膚情況也有報告,提示Stevens-Johnson 綜合症/表皮壞死性松解。
胃腸道異常
胃腸穿孔
肝臟異常
在用厄洛替尼單藥治療或聯合化療的患者中有報告肝衰竭。
禁忌
對本品及成份過敏者禁用。
注意事項
本品必須在有此類藥物使用經驗的醫生指導下使用。
警告
肺毒性
因 NSCLC、胰腺癌或其它實體瘤接受厄洛替尼治療的患者偶有報導嚴重間質性肺病樣事件,包括致命的情況。在隨機單藥治療NSCLC 試驗中(參見【臨床試驗】),維持治療研究中間質性肺病樣事件在厄洛替尼組和安慰劑組的發生率分別為0.7%和0%,二/三線治療研究中間質性肺病樣事件的發生率(0.8%)在厄洛替尼組和安慰劑組一樣。在治療胰腺癌試驗中-聯合吉西他濱(參見【臨床試驗】),間質性肺病樣事件的發生率在厄洛替尼+吉西他濱組為2.5%,在安慰劑+吉西他濱組為0.4%。
所有試驗中(包括無對照組試驗和聯合化療的試驗)共32000 例接受厄洛替尼治療患者總的間質性肺病樣事件發生率約為1.1%。
懷疑為間質性肺病樣事件的患者的診斷報告包括肺炎、放射性肺炎、過敏性肺炎、間質性肺炎、間質性肺病、閉塞性細支氣管炎、肺纖維化、急性呼吸窘迫綜合徵、肺浸潤和牙槽炎。症狀在服用厄洛替尼後5 天至9 個月(中位時間39 天)出現。大多數病例合併有其它引起間質性肺病的因素,如同時或既往的化療、既往放療、之前存在的間質性肺病、轉移性肺疾病或肺部感染。
一旦出現新的急性發作或進行性的不能解釋的肺部症狀如呼吸困難、咳嗽和發熱時,在診斷評價時要暫時停止厄洛替尼治療。一旦確診是ILD(間質性肺病),則應停止厄洛替尼治療,必要時給予適當的治療(參見【不良反應】和【用法用量】)
腹瀉、脫水、電解質失衡和腎衰
接受厄洛替尼治療的患者可能發生腹瀉,中度或重度腹瀉應給予洛哌丁胺治療。部分患者可能需要減量。對嚴重或持續的脫水相關腹瀉、噁心、厭食或者嘔吐,患者需停藥並對脫水採取適當的治療措施(見【不良反應】)。接受厄洛替尼治療的患者有肝腎綜合症、急性腎衰(包括死亡)和腎功能不全報告。有些由基線肝損傷引起,有些與腹瀉、嘔吐和/或厭食症引起的脫水或聯合化療有關。罕有伴隨低鉀血症和腎衰竭(包括致命)的嚴重脫水發生,主要是在接受同步化療的患者中。
對發生嚴重性腹瀉或持續性腹瀉、甚至脫水的患者,特別是存在高危險因素的患者群(例如接受同步化療、有其它症狀或疾病、或有包括年齡偏大等其它基礎因素的患者群),應中斷厄洛替尼治療,並採取適當措施對患者進行靜脈補液。對脫水患者應在補液的同時進行腎功能及血電解質包括血鉀的監測,建議定期監測有脫水風險患者的腎功能和血清電解質(見【不良反應】)。
心肌梗塞/心肌缺血
在胰腺癌臨床試驗中,在厄洛替尼/吉西他濱組中6 例患者(發生率2.3%)發生心肌梗塞/心肌缺血,其中1 例患者由於心肌梗塞死亡。相比之下,在安慰劑/吉西他濱組中3 例患者發生心肌梗塞(發生率1.2%),其中1 例由於心肌梗塞死亡。
腦血管意外
在胰腺癌臨床試驗中,在厄洛替尼/吉西他濱組中6 例患者(發生率2.3%)發生腦血管意外,其中出血1 次,是唯一的致命事件。相比之下,在安慰劑/吉西他濱組中沒有腦血管意外。
血小板減少引起的微血管溶血性貧血
在胰腺癌臨床試驗中,在厄洛替尼/吉西他濱組中2 例患者(發生率0.8%)發生血小板減少引起的微血管溶血性貧血。兩位患者均為同時使用了厄洛替尼和吉西他濱。相比之下,在安慰劑/吉西他濱組中沒有發生血小板減少引起的微血管溶血性貧血。
肝炎、肝衰竭
厄洛替尼使用期間報告了肝功能衰竭(包括死亡)的罕見病例。混雜因素包括既往肝臟疾病或合用肝毒性藥物。因此,這類患者應定期進行肝功能檢查。出現嚴重肝功能異常者應停止服用厄洛替尼。在檢查發現肝功能異常持續加重時,應考慮中斷和/或降低劑量同時增加肝功能檢查監測頻率。治療前檢查正常的情況下,如果總膽紅素]3 x ULN 和/或轉氨酶]5x ULN ,則應中斷或停止使用厄洛替尼(參見【不良反應】和【用法用量】)。
肝功能異常和肝損傷患者
離體和在體實驗均證明厄洛替尼主要在肝臟清除。因此肝功能異常的患者厄洛替尼的暴露量增加(參見【藥代動力學】特殊人群-肝臟功能異常患者和【用法用量】劑量調整)。
在中度肝損傷(Child-Pugh B)患者(與顯著肝腫瘤負荷有關)的藥代動力學研究中,15例患者中有10 例在治療期間或厄洛替尼末次給藥30 天內死亡。1 例患者死於肝腎綜合徵,1 例患者死於快速進展的肝功能衰竭,其餘8 例死於進展性疾病。10 例死亡患者中有8 例基線總膽紅素] 3 x ULN,這表明患有重度肝損傷,因此總膽紅素] 3 x ULN 的患者應慎用厄洛替尼。在厄洛替尼治療期間應對肝損傷(總膽紅素] ULN 或Child-Pugh A, B 和C)患者進行密切監測。治療前檢查異常的情況下,若肝功能出現重度變化,總膽紅素翻倍和/或轉氨酶升高三倍,則應中斷或停止使用厄洛替尼。(參見【用法用量】)
接受厄洛替尼治療的患者出現胃腸道穿孔的風險增加,但不常見(部分病例發生致命的後果)。同時合併使用抗血管生成藥、皮質激素類藥物、非甾體類抗炎藥(NSAIDs)、和/或紫杉類藥物為基礎的化療,或者既往有消化性潰瘍或憩室疾病病史的患者風險更高。出現胃腸道穿孔的患者應永久停用厄洛替尼(見【不良反應】)。
大皰性或剝脫性皮膚改變
有報導大皰性,水泡性和剝脫性皮膚症狀,包括非常罕見的Stevens-Johnson 綜合徵/中毒性表皮壞死松解症, 有些情況下是致命的(見【不良反應】)。如患者出現嚴重的大皰性,水泡性和剝脫性皮膚症狀,應中斷或停用厄洛替尼。
眼部疾病
使用厄洛替尼治療有非常罕見的角膜穿孔或角膜潰瘍的報導。還觀察到的其他眼部異常包括異常睫毛生長、乾燥性角膜結膜炎或皰疹性角膜炎,這些也是發生角膜穿孔/潰瘍的危險因子。如患者出現急性眼科異常或加重例如眼睛疼痛,應中斷或停用厄洛替尼(見【不良反應】)。
相互作用
厄洛替尼可能存在有臨床意義的藥物-藥物相互作用(見【藥物相互作用】)。
國際標準化比值升高和出血可能
在接受本品治療的患者中有報導表明,與香豆素類抗凝藥包括華法林的相互作用導致國際標準化比值(INR)升高和出血事件增加,部分病例產生致命後果。應對使用香豆素類抗凝藥的患者的凝血時間和INR 變化進行定期監測。
該片劑中含有乳糖,因此患有罕見遺傳病半乳糖不耐受、Lapp乳糖酶缺乏症或葡萄糖-半乳糖吸收不良的患者不應使用本品。
對駕駛和機械操作能力的影響
尚未進行本品對駕駛和機械操作能力影響的研究,但厄洛替尼對精神能力無影響。
孕婦及哺乳期婦女用藥
妊娠D類
未在妊娠婦女中進行厄洛替尼的充分、對照性研究。生育期婦女服用厄洛替尼期間應避免妊娠。在治療期間和治療完成後至少2周應充分避孕。只有認為母親的受益大於對胎兒的危害妊娠女性才能繼續治療。如果妊娠期間使用厄洛替尼,患者應了解對胎兒的潛在危害和可能導致流產。
不清楚人乳汁中是否分泌有厄洛替尼。因為許多藥物可分泌到人乳汁中而且厄洛替尼對嬰兒的影響尚未研究,建議婦女使用厄洛替尼時避免哺乳。
兒童用藥
未在兒童中進行厄洛替尼的有效性和安全性研究。不建議兒童使用厄洛替尼。
老年用藥
NSCLC維持治療
參加隨機NSCLC 維持治療試驗的所有患者中,約66%的患者小於65 歲,34%的患者等於或大於65 歲。65 歲以下患者總生存期的風險比為0.78 (95% CI: 0.65, 0.95),65 歲或以上患者總生存期的風險比為0.88 (95% CI: 0.68, 1.15)。
NSCLC二/三線治療
參加NSCLC 隨機試驗的總人群中,62%的患者小於65 歲,而38%的患者為65 歲以上。在兩個年齡組中都可獲得生存受益(參見【臨床試驗】)。
胰腺癌一線治療
在胰腺癌試驗中,53%的患者小於65 歲,而47%的患者為65 歲以上。年輕或老年患者之間未見有意義的安全性和藥代動力學差異。因此推薦對老年患者不需要劑量調整。
藥物相互作用
僅在成人中進行了相互作用研究。
體外研究發現,厄洛替尼是CYP1A1 的強效抑制劑、CYP3A4 和CYP2C8 的中度抑制劑、UGT1A1 誘導的葡萄苷酸化的強抑制劑。
由於CYP1A1 在人體組織中的表達十分有限,無從獲得CYP 1Al 強抑制劑的生理學相關性。
對葡萄苷酸化的抑制作用可能會導致與一些僅能通過該途徑清除的UGT1Al 底物類藥物發生相互作用。對於UGT1A1 表達水平較低或患有遺傳葡萄苷酸化疾病(如Gilbert 疾病)的患者,其血清膽紅素濃度可能升高,必須慎用。
厄洛替尼經肝臟代謝,主要通過CYP3A4,少量通過CYP1A2 和肺同工酶CYP1A1。任何通過這些酶代謝的藥物或者酶的抑制劑或誘導劑均有可能與厄洛替尼發生相互作用。
CYP3A4 強抑制劑可以降低厄洛替尼代謝,使其血藥濃度升高。與單獨使用厄洛替尼相比,酮康唑(200mg 每天2 次服用5 天)通過抑制CYP3A4 代謝活性導致厄洛替尼的AUC增加(平均AUC 增加86%]),Cmax 增加69%。厄洛替尼與CYP3A4 和CYP1A2 抑制劑環丙沙星合用時,厄洛替尼的AUC 及Cmax 分別增加39%和17%,活性代謝產物的AUC 和Cmax 分別約增加了60%和48%,目前還未明確該暴露增加的臨床相關性。厄洛替尼慎與環丙沙星或強效CYP1A2 抑制劑(如氟伏沙明)聯用。因此,厄洛替尼與CYP3A4 強抑制劑或結合的CYP3A4 /CYP1A2 抑制劑合用時應注意,一旦發現毒性作用,應當降低厄洛替尼劑量。
CYP3A4 強誘導劑可提高厄洛替尼的代謝,顯著降低厄洛替尼的血藥濃度。與單獨使用厄洛替尼相比,給予150mg 厄洛替尼後,利福平(600mg 每天1 次服用7 天)通過誘導CYP3A4代謝活性導致厄洛替尼的平均AUC 降低69%。
若治療前已使用或治療中並用利福平,單劑給藥450 mg 後厄洛替尼的平均AUC 是未經利福平治療時單劑給藥150 mg 厄洛替尼後的57.5%。如可能,應選擇其他不具強CYP3A4誘導性的藥物治療。對於需要採用厄洛替尼 + 強CYP3A4 誘導劑(如利福平)治療的患者,應在密切監控藥物安全性情況下(見【注意事項】)考慮將劑量增至300 mg,如能良好耐受2 周以上,可考慮將劑量進一步增至450 mg,同時密切監控藥物安全性。此條件下未對更高的劑量進行研究。在與其它誘導劑,如苯妥英、卡馬西平、巴比妥類或聖約翰草(St. JohnsWort)合用時,暴露量可能也會降低,厄洛替尼與這些活性藥物合用時應特別小心。可能的情況下,可以考慮使用其它無強效CYP3A4 誘導活性的治療藥物。
厄洛替尼預治療或合用對典型的CYP3A4 底物咪達唑侖和紅黴素的清除率沒有影響。因此,與其他CYP3A4 底物清除間的顯著相互作用也不可能發生。咪達唑侖口服利用度似乎降低了24%,但這並非CYP3A4 活性的影響所致。在另一項臨床試驗中,厄洛替尼與CYP3A4/2C8 底物紫杉醇合用,對其藥代動力學無影響。因此與其它CYP3A4 底物的清除可能也無顯著相互作用。
厄洛替尼的溶解度與pH 值相關。pH 值升高時,厄洛替尼的溶解度降低。改變上消化道pH 值的藥物可能會改變厄洛替尼的溶解度,進而影響其生物利用度。厄洛替尼與質子泵抑制劑奧美拉唑合用,厄洛替尼的AUC 和Cmax 分別降低了46%和61%。Tmax 或半衰期無變化。厄洛替尼與300mg H2 受體阻斷藥雷尼替丁合用時,厄洛替尼的AUC 和Cmax 分別降低33%和54%。因此,可能的情況下應當避免厄洛替尼與減少胃酸產生的藥物合用。在與這些藥物合用時增加厄洛替尼的劑量不太可能補償暴露量的減少。然而,厄洛替尼與雷尼替丁間隔給藥時(雷尼替丁150mg 每日兩次,給藥前2 小時或給藥後10 小時給予厄洛替尼),厄洛替尼的AUC 和Cmax 分別只減少15%和17%。如果患者需要接受此類藥物治療,H2 受體阻斷藥如雷尼替丁應當考慮並採取間隔給藥。須在H2 受體阻斷藥給藥前2 小時或給藥後10小時給予厄洛替尼。
厄洛替尼為P-糖蛋白活性底物轉運體的底物,與Pgp 抑制劑(如環孢菌素和維拉帕米)合用可能會改變厄洛替尼的分布和/或消除,目前尚不清楚該相互作用結果對毒性(如CNS)的影響,所以在此情況下應慎用。
厄洛替尼會增加鉑濃度。在一項臨床研究中,厄洛替尼與卡鉑和紫杉醇合併用藥使總鉑AUC0-48 增加了10.6%。雖然該差異具有統計學顯著意義,但認為該差異程度不具有臨床相關性。在臨床實踐中,可能還存在一些其它導致卡鉑暴露量增加的共同因素,如腎損傷。卡鉑和紫杉醇對厄洛替尼的藥代動力學無顯著影響。
卡培他濱可能會增加厄洛替尼的濃度。厄洛替尼與卡培他濱合用時,與另外一項厄洛替尼單藥研究中的數據相比,厄洛替尼AUC 出現統計學顯著增加,Cmax 值也出現臨界意義的增加。厄洛替尼對卡培他濱的藥代動力學無顯著影響。
本品與他汀類藥物合用可能增加他汀類藥物引起的肌病包括罕見的橫紋肌溶解症的發生率。
已知吸菸會誘導CYP1A1 和CYP1A2,導致厄洛替尼暴露量減少50-60%,建議吸菸者戒菸(見【用法用量】和【藥代動力學】特殊人群)。
藥物過量
健康受試者中單次口服劑量1000mg和癌症患者單次口服1600mg能夠耐受。健康受試者每天兩次200mg劑量僅數天的耐受性很差。根據這些試驗的資料,超過每天150mg的推薦劑量時可能發生不能接受的嚴重不良事件(如腹瀉、皮疹和肝臟轉氨酶升高,見【用法用量】)。懷疑過量時應停止厄洛替尼和給予對症治療。
臨床試驗
 特羅凱
特羅凱NSCLC維持研究
一項隨機、雙盲、安慰劑對照研究(BO18192)評價了厄洛替尼用於維持治療的有效性和安全性,本研究在26 個國家開展,共入組889 例接受一線含鉑化療後未發生疾病進展的局部晚期或轉移性NSCLC 患者,按1:1 隨機分組至每日一次厄洛替尼150 mg 組或安慰劑組(厄洛替尼組438 例,安慰劑組451 例),用藥直至疾病進展。研究主要目的是確定所有患者或EGFR 免疫組化(IHC)陽性腫瘤患者接受標準含鉑化療後再給予厄洛替尼治療時,與安慰劑相比無進展生存期(PFS)是否有所改善。
兩治療組的人口學特徵相似(表5)。
表5:人口學特徵與疾病特徵:
- ITT人群結果:
所有患者(n=889)的主要PFS分析顯示,厄洛替尼組相對安慰劑組的PFS風險比為0.71(95% CI, 0.62-0.82;p[O.000l),厄洛替尼組的平均PFS為22.4周,安慰劑組為16.0周。該PFS結果得到了獨立閱片的確證。厄洛替尼組的生活質量數據與安慰劑組相比未顯示不利影響。
在EGFR IHC陽性的患者人群中(n=621),PFS風險比為0.69(95% CI, 0.58-0.82;p [0.0001),厄洛替尼組的平均PFS為22.8周(範圍0.1-78.9周),而安慰劑組為16.2周(範圍0.1-88.1)。厄洛替尼與安慰劑組的6個月無進展生存率分別為27%和16%。
次要終點總生存期(OS)的風險比為0.81 (95% CI, 0.70-0.95;p=O.0O88),厄洛替尼組中位總生存期為12.0個月,而安慰劑組為11.0個月。圖1為總生存期的Kaplan Meier曲線。
EGFR活化突變患者的獲益最大(n =49, PFS HR=0. 10, 95 % CI, 0.04-0.25;p[O.0001)。在EGFR野生型患者中,PFS HR為0.78 (95% CI, 0.63-0.96;p=O.Ol85) ,OS HR為0.77 (95%CI, 0.61-0.97;p=O.O243)。
腺癌和鱗癌患者的OS風險比分別為0.77 (95% CI: 0.61, 0.97),0.86 (95% CI: 0.68, 1.10)。
圖1 總生存期的Kaplan Meier曲線(ITT人群)
注釋:HR是根據單變數Cox回歸模型而得的。
- 化療後疾病穩定患者:
病情穩定患者(SD) (n=487)的PFS HR為0.68 (95% CI, 0.56-0.83;p[O.0001;厄洛替尼組中位值為12.1周,安慰劑組為11.3周),OS HR為0.72 (95% CI, 0.59-0.89;p =0.0019;厄洛替尼組中位OS為11.9個月,安慰劑組為9.6個月)。
在接受厄洛替尼治療疾病穩定的患者中,不同亞組總生存期的探索性分析顯示鱗狀細胞癌(HR 0.67, 95% CI, 0.48-0.92)與非鱗狀細胞癌(HR 0.76, 95% CI 0.59- 1.00)患者之間、EGFR活化突變(HR0.48, 95% 0.14-1.62)與無EGFR活化突變 (HR 0.65, 95% CI 0.48-0.87)患者之間不存在實質差異。
- SATURN研究中進展患者的後續治療
在SATURN 研究的ITT(意向治療)人群中,安慰劑組有72%的患者接受了後續治療,包括手術、放療、全身治療等。在66%的接受全身治療的安慰劑組患者中,28%的患者接受了多西他賽治療,17%的患者接受了培美曲塞治療,15%的患者接受了厄洛替尼治療(詳見表6)。
表6 後續治療(ITT)
*至少接受一次後續全身治療藥物的患者百分比
**患者可以接受一次以上的後續治療
目前尚缺乏對一線治療後無進展人群接受厄洛替尼和進展後再接受厄洛替尼的治療效果進行比較的隨機對照的臨床試驗數據。在SATURN研究的ITT人群中,共有67例的安慰劑組患者接受厄洛替尼作為二線或二線以上治療方案。然而,由於僅有那些預後相對較好的患者才有足夠長的生存期並能夠接受後續治療,並且接受二線治療的患者群體中已排除了體力狀況欠佳不能耐受治療或已早期死亡的患者,因此接受治療的患者群體差異使SATURN研究中比較438例接受厄洛替尼維持治療患者與67例接受厄洛替尼二線治療患者的生存期意義有限。因而SATURN的研究設計無法證實在一線化療後無進展人群立即使用厄洛替尼維持治療和化療後待出現疾病進展再使用厄洛替尼二線治療兩種模式之間的差異。
目前羅氏公司正在計畫一項比較厄洛替尼用作一線維持治療及二線治療的療效差異的臨床研究。
厄洛替尼單藥治療非小細胞肺癌
在既往至少一個化療方案失敗的局部晚期或轉移性NSCLC患者中,進行了隨機雙盲安慰劑對照的試驗,評價厄洛替尼單藥治療的有效性和安全性,731例患者按2:1的比例隨機接受每日一次厄洛替尼150mg或安慰劑治療(厄洛替尼組488例,安慰劑組243例),直至疾病進展或有不能接受的毒性反應。試驗的療效指標包括總生存期、客觀緩解率和無疾病進展時間(PFS)。也評價緩解持續時間。主要療效指標是生存期。試驗在17個國家開展。大約1/2患者(326例)有EGFR表達情況資料。
表7總結了試驗人群的一般情況和疾病特點。兩個治療組患者的一般情況是很均衡的。大約2/3患者為男性。大約1/4患者基線ECOG體能評分(PS)為2分,9%基線ECOG PS為3分。50%患者既往僅接受過一個化療方案。大約3/4患者有吸菸史。
表7:一般情況和疾病特點
*基線時的分層因素;分布上與隨機化時報告的值稍有差異。
試驗結果見表8。
表8:療效結果
(1)以ECOG行為狀態評分、既往化療方案數、既往化療含鉑類和既往化療的最好療效為協變數的COX回歸模型分析。
(2)以ECOG行為狀態評分、既往化療方案數、既往化療含鉑類和既往化療的最好療效分層的雙側Log-Rank檢驗。
(3)雙側Fisher's精確檢驗。
在有治療意向人群中進行生存期分析。圖1顯示了總生存期的Kaplan-Meier曲線。主要療效指標生存期和PFS分析是以ECOG行為狀態評分、既往化療方案數、既往化療含鉑類和既往化療的最好療效分層的雙側Log-Rank檢驗。
圖2:治療組患者總生存期的Kaplan-Meier曲線
注意:HR是從以ECOG行為狀態評分、既往化療方案數、既往化療含鉑類和既往化療的最好療效為協變數的COX回歸模型分析中得出。P值是從以ECOG行為狀態評分、既往化療方案數、既往化療含鉑類和既往化療的最好療效分層的雙側Log-Rank檢驗中得出。
在探索性單變數分析中研究了一系列亞組患者。圖2顯示了分析結果。大多數亞組患者中厄洛替尼治療的生存期相似。但在兩個亞組中療效更明顯:腫瘤EGFR陽性的患者(HR=0.68)和不吸菸患者(HR=0.42)。下面進一步討論這些亞組情況。
圖3:根據治療前特點所分各亞組患者的生存相對風險比(厄洛替尼比安慰劑)
注意:顯示了服用厄洛替尼患者與服用安慰劑患者相比每個亞組的單變數死亡HR,HR的95%可信區間(CI)和樣本量(N)大小。水平線上的垂直標記代表HR,水平線的長短表示95%CI。垂直標記的豎線的左側代表HR小於1.00,表示這個亞組患者厄洛替尼治療組與安慰劑組相比生存期要長。
厄洛替尼單藥治療NSCLC的療效與EGFR蛋白表達情況(免疫組化方法測定)的關係
EGFR表達情況與治療效果關係的分析是有局限性的,因為僅有326例(45%)患者的EGFR表達情況。對在試驗入組前有組織標本的患者的EGFR表達情況進行了測定。儘管如此,檢測了EGFR表達情況患者的生存期以及厄洛替尼單藥治療的療效與整體試驗人群中的結果幾乎完全一致,提示EGFR檢測人群是具有代表性的樣本。EGFR表達情況陽性定義為至少10%的細胞EGFR染色,而EGFR pharmDxTM試劑盒說明中特定的陽性值為1%。pharmDx試劑盒用於非小細胞肺癌尚未經過驗證。
厄洛替尼單藥治療能延長EGFR陽性亞組患者的生存期(N=185,HR=0.68,95%CI=0.49-0.94)(圖4),延長未測定EGFR亞組患者的生存期(N=405,HR=0.77,95%CI=0.61-0.98)(圖6),但對EGFR陰性亞組患者的生存期無影響(N=141,HR=0.93,95%CI=0.63-1.36)(圖5)。但是EGFR陽性、陰性和未測定亞組的可信區間很寬並互相重疊,所以不能排除厄洛替尼對EGFR陰性的NSCLC患者也可延長生存期。
對不吸菸亞組患者,EGFR狀況也可預測厄洛替尼的生存獲益。厄洛替尼對不吸菸且EGFR陽性的患者延長生存期作用更顯著(N=41,HR=0.28,95%CI=0.13-0.61)。不吸菸且EGFR陰性的患者太少,尚不能得出結論。
所有EGFR亞組腫瘤的緩解率:EGFR陽性組為11.3%,EGFR未測定組為9.5%,EGFR陰性組為3.8%。無進展生存期在EGFR陽性亞組患者延長(HR=0.49,95%CI=0.35-0.68),在未測定EGFR亞組患者也延長(HR=0.60,95%CI=0.47-0.75),在EGFR陰性亞組患者不確定(HR=0.80,95%CI=0.55-1.16)。
圖4:EGFR陽性患者的生存期
圖5:EGFR陰性患者的生存期
圖6:未測定EGFR的患者的生存期
一項厄洛替尼單藥用於至少一個化療方案治療失敗的局部晚期或轉移性NSCLC的開放性、單組、非對照大樣本國際多中心臨床研究(TRUST 研究)中,患者接受厄洛替尼150mg每日一次口服的治療,直到疾病進展或不能耐受毒副反應,評價療效和安全性。數據截至2009 年2 月24 日,對全球共6586 例患者進行了數據分析,其中包括519 例中國患者。
根據患者基線特徵分布數據,中國患者同全球患者相比,患者年齡、性別、ECOG 體力狀態、腫瘤分期等分布基本一致。在中國患者中,非吸菸患者和腺癌患者的比例略高,這和東西方非小細胞肺癌的流行病學分布特徵一致。中國患者中,除1 名患者以外,全部為二/三線治療,而在全球患者中有13%是作為一線治療。
本次分析中中國患者與全球所有患者的基線特徵詳見表9。
表9 TRUST患者基線特徵:中國患者和全球患者
在有緩解率數據的全球患者中,接受厄洛替尼治療的緩解率為13%,疾病控制率為69%,中位疾病進展時間為3.25 月,中位生存期8.15 月。在接受厄洛替尼二線治療的患者中,緩解率為12%,疾病控制率為68%,中位無進展生存期為3.15 月,中位生存期8.87 月,和接受厄洛替尼三線治療的患者相似(分別為9%,67%,3.18 月和7.29 月)。
中國患者的治療結果分析顯示,中國患者接受厄洛替尼治療的緩解率達26.6%,疾病穩定率達54.7%,疾病控制率達81.3%,患者的中位無進展生存期達到6.44 個月,中位生存期達15.37 個月,均明顯優於在西方患者中觀察到的療效。
表10 TRUST研究主要療效結果:中國患者和全球患者
厄洛替尼聯合化療治療NSCLC
兩個多中心安慰劑對照隨機試驗包括了1000多例局部晚期或轉移性NSCLC一線治療的患者,結果顯示與鉑類為基礎的化療(卡鉑+紫杉醇,厄洛替尼,N=526;吉西他濱+順鉑,厄洛替尼,N=580)同時服用厄洛替尼無臨床受益。
特殊人群
性別
NSCLC 維持治療
維持治療隨機對照試驗的所有患者中,男性占73%,女性占27%。不同性別患者的安全性和有效性未顯示有臨床意義的差異[男性OS HR = 0.88 (95% CI: 0.74 - 1.05),女性OSHR = 0.64 (95% CI: 0.46 - 0.91)]。
NSCLC 二/三線治療
二/三線NSCLC 隨機對照試驗的所有患者中,男性占65%,女性占35%。不同性別患者的安全性和有效性未顯示有臨床意義的差異[男性OS HR = 0.76 (95% CI: 0.6 - 0.9),女性OS HR = 0.80 (95% CI: 0.6 - 1.1)]。
種族
NSCLC 維持治療
維持治療隨機對照試驗的所有患者中,約84%為高加索人,15%為亞洲人。不同種族患者的安全性和有效性未顯示有臨床意義的差異[高加索人OS HR = 0.86 (95% CI: 0.73 - 1.01),亞洲人OS HR = 0.66 (95% CI: 0.42 - 1.05)]。
NSCLC 二線/三線治療
二/三線NSCLC 隨機對照試驗的所有患者中,約78%為高加索人,13%為亞洲人。不同種族患者的安全性和有效性未顯示有臨床意義的差異[高加索人OS HR = 0.79 (95% CI: 0.6 -1.0),亞洲人OS HR = 0.61 (95% CI: 0.4 - 1.0)]。
藥理毒理
藥理作用:
厄洛替尼是表皮生長因子受體(EGFR)/人表皮生長因子受體I(也稱為HER1)的酪氨酸激酶抑制劑。厄洛替尼可有效抑制細胞內的EGFR 磷酸化,EGFR 通常表達於正常細胞和腫瘤細胞的表面。在非臨床試驗模型中,EFGF 磷酸化的抑制可引起細胞生長停滯和/或細胞死亡。
毒理研究:
慢性毒性實驗研究顯示,至少在一種動物種屬中出現了角膜病變(萎縮,潰瘍),皮膚病變(濾泡變性、炎症、紅腫和脫毛),卵巢萎縮,肝組織壞死,腎乳頭壞死和腎小管擴張,和胃腸道反應(延遲胃排空和腹瀉)。紅細胞參數下降,白細胞參數(主要為嗜中性粒細胞)增加。出現了用藥相關的ALT、AST 和膽紅素升高。上述反應均發生在臨床的藥物暴露水平之下。
厄洛替尼在UV 照射下有輕微光毒性。在一系列體外實驗(細菌突變、人淋巴細胞染色體畸變和哺乳細胞突變)和體內小鼠骨髓微核實驗中分析了厄洛替尼的遺傳毒性,結果未發現有遺傳毒性。
根據厄洛替尼的作用模式認為它具有潛在的致癌性。在臨床前研究中沒有觀察到潛在致癌性的證據。在遺傳毒性研究中,厄洛替尼既無遺傳毒性,也無致畸變作用。已經開始在大鼠和小鼠中開展長期致癌性研究,6 個月的慢性毒性研究中尚未觀察到癌前增生性病變。
生殖毒性試驗結果顯示出現了生殖發育毒性(如大鼠的胚胎毒性、胚胎再吸收和家兔的胎仔毒性;大鼠胎仔生長減緩和存活下降),但未見致畸性和對生育力有影響。這些反應均發生在臨床治療的有關濃度。
當家兔厄洛替尼血漿藥物濃度達到大約人的血漿濃度(每日150mg 的AUC)3 倍時可以出現母體毒性導致胚胎/胎兒死亡和流產。器官形成期間給藥血漿藥物濃度達到大約人的血漿濃度(根據AUC)時在家兔和大鼠中不會增加胚胎/胎兒死亡和流產。但是雌性大鼠在交配前到妊娠第一周接受30mg/m2/d 到60mg/m2/d 的厄洛替尼(根據mg/m2 計算相當於臨床劑量的0.3-0.7 倍)可以引起早期吸收而導致成活胎兒數量下降。
藥代動力學
尚缺乏在中國人中進行藥代動力學研究的數據。以下資料來自國外臨床研究。
吸收和分布
厄洛替尼口服150mg 劑量時厄洛替尼的生物利用度大約為60%,用藥後4 小時達到血漿峰濃度。食物可顯著提高生物利用度,達到幾乎100%。吸收後大約93%厄洛替尼與白蛋白和α1 酸性糖蛋白(AAG)結合。厄洛替尼的表觀分布容積為232 升。一項研究考察了厄洛替尼在人體腫瘤組織中的分布情況,4 名患者(3 例NSCLC, 1 例喉癌)接受厄洛替尼150 mg 每天一次口服,在治療第9 天手術切除腫瘤樣本顯示腫瘤組織中厄洛替尼濃度平均為 1,185 ng/g 組織。相當於穩態峰濃度的63%(5-161 %)的總體平均值。腫瘤組織中主要活性代謝物平均濃度為160 ng/g 組織,相當於穩態血漿峰濃度的113%(88-130%)的總體平均值。血漿蛋白結合近95%。厄洛替尼與血清肌酐和alpha-1 酸性糖蛋白(AAG)結合。
代謝和清除
體外細胞色素酶P450 分析表明厄洛替尼主要通過CYP3A4 代謝,少量通過CYP1A2 和肝外同工酶CYP1A1 代謝。肝外代謝包括小腸內CYP3A4 代謝、肺內CYP1A1 代謝以及腫瘤組織內1B1 代謝,可能對厄洛替尼的代謝清除有一定作用。
已經證實的3 種代謝途徑有:1)單側鏈或雙側鏈的O-脫甲基化,再進一步氧化成羧酸;2)乙炔基的氧化,再進一步水解成芳香羧酸;3)苯乙炔基的芳香環羥化。厄洛替尼兩個側鏈中的任一個經O-脫甲基後產生了主要代謝產物OSI-420 和OSI-413,在非臨床體外測定與體內腫瘤模型中,顯示這兩個代謝產物的效價與厄洛替尼相當, 其在血漿中的水平[10 %的厄洛替尼,但藥代動力學特徵與厄洛替尼相似。
口服100mg 劑量後,可以回收到91%的藥物,其中在糞便中為83%(原形藥占給予劑量1%),尿液中為8%(原形藥占給予劑量0.3%)。
591 例服用單劑厄洛替尼的人群藥代動力學分析表明中位半衰期為36.2 小時。因此達到穩態血漿濃度需要7-8 天。清除率與年齡之間無明顯相關性。吸菸者厄洛替尼的清除率增高24%。
在 291 例NSCLC 患者中進行了一項補充的群體藥代動力學研究,厄洛替尼單藥用於維持治療。分析結果表明,在此患者人群中影響厄洛替尼清除率的協變數與先前的單藥藥代動力學分析結果相似,未發現新的協變數效應。
另外一項204例接受厄洛替尼+吉西他濱聯合用藥的胰腺癌患者的藥代動力學分析結果表明,胰腺癌試驗中影響厄洛替尼清除率的因素與先前單藥的藥代動力學分析類似。沒有觀察到新的影響因素。與吉西他濱聯合用藥對厄洛替尼的血漿清除率無影響。
特殊人群
群體藥代動力學分析顯示,預測的表觀清除率與患者年齡、體重、性別和種族之間不存在臨床意義的關係。與厄洛替尼藥代動力學相關的患者因素有血清總膽紅素、AAG和當前吸菸狀況,血清總膽紅素濃度和AAG濃度的增加與厄洛替尼清除率的下降有關,這些差異的臨床顯著性尚不清楚。
尚未對兒童和老年患者進行專門研究。
肝功能異常患者
厄洛替尼主要在肝臟清除。中度肝功能損傷患者(Child-Pugh 分級7-9)與肝功能正常患者的厄洛替尼暴露量類似,包括原發性肝癌和肝轉移患者。在中度肝功能不全(Child-Pugh分級 7-9)的實體瘤患者中,厄洛替尼AUC 0-t 和Cmax 的幾何平均數分別為27000 ng.h/mL和805 ng/mL,與之相比,在重度肝功能不全的患者(包括原發性肝癌或肝轉移患者)中,這兩個值分別為29300 ng.h/mL 和1090ng/mL。雖然在中度肝功能損害患者中Cmax 較低,且差異具有統計學意義,但不認為該差異具有臨床顯著意義。目前尚無有關重度肝功能損傷對厄洛替尼藥代動力學的影響的數據。在群體藥代動力學分析中發現,總膽紅素血清濃度的增加與厄洛替尼清除率的速率變慢有關。
腎功能異常患者
單劑給藥後尿中分泌少於9%。在腎功能異常的患者中未進行臨床試驗。
吸菸患者不吸菸和正在吸菸的健康志願者的藥代動力學研究顯示吸菸會導致厄洛替尼清除增加、暴露減少。一項在不吸菸和當前吸菸健康志願者中進行的每日口服厄洛替尼150mg 藥代動力學研究證實了這一點。非吸菸者Cmax 幾何平均數為1056 ng/mL,吸菸者為689 ng/mL,吸菸者與非吸菸者的平均比值為65.2 %(95 % CI: 44.3-95.9, p=0.031)。非吸菸者AUC0-inf 幾何平均數為18726 ng.h/mL,吸菸者為6718 ng•h/mL,吸菸者與非吸菸者的平均比值為35.9%(95 % CI: 23.7-54.3, p [0.0001)。非吸菸者C24h 幾何平均數為288 ng/mL,吸菸者為34.8ng/mL,吸菸者與非吸菸者的平均比值為12.1 %(95 % CI: 4.82-30.2, p=0.0001)(吸菸組和從不吸菸/既往吸菸組各16 位受試者)。正在吸菸者暴露量的減少可能是由於對肺CYP1A1 和肝臟CYP1A2 的誘導作用。
關鍵III 期NSCLC 臨床試驗(BR.21)中,正在吸菸者的厄洛替尼穩態血漿谷濃度為0.65 μg/mL(n=16),約為既往吸菸者或從不吸菸者的1/2(1.28 μg/mL,n=108),厄洛替尼表觀血漿清除率增加24%。
正在吸菸的NSCLC 患者的I 期劑量爬坡研究中,穩態藥代動力學分析顯示厄洛替尼從150mg 增加到最大耐受劑量300mg 過程中,厄洛替尼暴露量隨劑量成比例增加。300mg 劑量水平下,正在吸菸患者的穩態血漿谷濃度為1.22 μg/mL(n=17)(見【用法用量】和【藥物相互作用】)。
相互作用
厄洛替尼主要通過CYP3A4 代謝,因此推測CYP3A4 的抑制劑會使其暴露增加。與CYP3A4 的強抑制劑酮康唑聯合使用時厄洛替尼的AUC 提高了2/3(見【藥物相互作用】、【用法用量】中的劑量調整部分)。
治療前使用或者同時使用CYP3A4 誘導劑利福平可以使厄洛替尼的清除提高3 倍,同時使厄洛替尼的 AUC 下降2/3(見【藥物相互作用】和【用法用量】中的劑量調整部分)
在一項Ib 期臨床試驗中,吉西他濱和厄洛替尼的藥代動力學沒有發生顯著的相互影響。
群體藥代動力學分析顯示,阿片類藥物可使厄洛替尼暴露量約增加11 %。
貯藏
25℃保存。15-30℃之間亦可接受。
藥品應放於小孩接觸不到處。
其他
【規 格】150mg
【貯 存】25℃保存,15℃~30℃之間也可接受。
 特羅凱
特羅凱【包 裝】PVC泡罩包裝;30片/盒。
【新包】7片/盒
【有效期】36個月
【進口藥品註冊證號】H20060108
【生產企業】Roche Pharma(Schweiz)Ltd.
特羅凱的作用機理是什麼?
特羅凱的作用途徑與化療不同,是一種靶向治療藥物,可特異性地針對腫瘤細胞作用,抑制腫瘤的形成和生長。它是一種小分子化合物,可抑制人表皮生長因子受體(EGFR)的信號傳導途徑;是表皮生長因子(又可稱HER1)信號傳導通路的關鍵組分,在多種腫瘤細胞的形成及生長中都扮演了重要的角色。特羅凱的通過抑制酪氨酸激酶的活性的方式來抑制腫瘤生長,酪氨酸激酶是EGFR細胞內的重要組成部分之一。
特羅凱是否會引起化療常見的不良反應?禁忌症?
特羅凱是一種小分子化合物,可抑制人表皮生長因子受體(EGFR)的信號傳導途徑;這一作用方式與傳統的化療截然不同,因此不會導致化療中常見的不良反應。僅禁用於對特羅凱及輔料嚴重過敏的患者。
特羅凱何時得到了美國和 中國食品藥品管理局(FDA)的許可?
美國FDA於2004年11月19日批准特羅凱用於治療既往化療失敗的局部進展性或轉移性NSCLC患者。中國FDA於2006年4月6日批准。
執行標準
進口藥品註冊標準JX20080202
生產企業
Schwarz Pharma Manufacturing Inc.
修訂日期
2009年01月19日 2009年03月10日 2009年09月30日 2009年11月11日 2010年04月28日 2011年06月29日
贈藥項目
目的
秉承中華慈善總會一貫宗旨,幫助低收入人群在重大疾病情況下的救助,滿足並鼓勵患者與疾病抗爭的物質與精神需求,以幫助晚期肺癌患者獲得更大支持。在中華慈善總會的領導下,上海羅氏製藥有限公司的大力支持下,開展了“中華慈善總會特羅凱®慈善贈藥項目”。
啟動時間
2008年4月。
截止時間
如果因不可抗力或因特殊原因必須停止贈藥,我們會提前通過多種渠道告知公眾。對於已經預約成功和已經開始領藥的患者,我們將保證這些患者的持續贈藥直至患者到達停藥的標準。
援助對象
· 本人知曉自己患晚期肺癌、經指定醫療機構評估確認為符合特羅凱®適應症(復治的原發性晚期非小細胞肺癌,服藥前經過至少一次的全身化療)的低保患者(享有低保待遇至少一年)。
服藥前經過至少一次的全身化療)的非低保患者,經過連續6個月特羅凱®治療獲得明顯療效且無疾病進展,但因經濟原因無法繼續承擔藥品費用。
*因援助數量有限,滿足上述條件並不等於一定能得到贈藥。
項目監查
項目組對獲贈患者定期進行抽查,核對個人信息和病歷資料,如發現任何醫學條件或經濟條件不符將立即停止贈藥。