結構
在蛋白質三級結構內的獨立摺疊單元。結構域通常都是幾個超二級結構單元的組合至蛋白質多肽鏈在二級結構的基礎上進一步捲曲摺疊成幾個相對獨立的近似球形的組裝體。
結構域(Structural Domain)是介於二級和三級結構之間的另一種結構層次。所謂結構域是指蛋白質亞基結構中明顯分開的緊密球狀結構區域,又稱為轄區。多肽鏈首先是在某些區域相鄰的胺基酸殘基形成有規則的二級結構,然後,又由相鄰的二級結構片段集裝在一起形成超二級結構,在此基礎上多肽鏈摺疊成近似於球狀的三級結構。對於較大的蛋白質分子或亞基,多肽鏈往往由兩個或多個在空間上可明顯區分的、相對獨立的區域性結構締合而成三級結構,這種相對獨立的區域性結構就稱為結構域。對於較小的蛋白質分子或亞基來說,結構域和它的三級結構往往是一個意思,也就是說這些蛋白質或亞基是單結構域。結構域自身是緊密裝配的,但結構域與結構域之間關係鬆懈。結構域與結構域之間常常有一段長短不等的肽鏈相連,形成所謂鉸鏈區。不同蛋白質分子中結構域的數目不同,同一蛋白質分子中的幾個結構域彼此相似或很不相同。常見結構域的胺基酸殘基數在100~400個之間,最小的結構域只有40~50個胺基酸殘基,大的結構域可超過400個胺基酸殘基。
分類
為了研究蛋白質分子結構的基本規律,人們用不同的方法從不同的角度對已知的蛋白質結構進行分類,有些是基於生物功能,有些是基於結構自身,有些是將二者結合在一起進行分類研究。例如,鋅金屬蛋白酶是一類可催化肽鏈內部肽鍵水解的肽鏈內切酶,儘管所屬的各個亞家族成員的整體空間結構差異顯著,但催化活性部位的結構非常類似,故將它們歸屬於一類蛋白。
然而,最為人們熟悉的還是M.Levitt和C.Chothia對蛋白質結構進行的分類。此方法認為二級結構的組合構成了大多數結構域結構的核心,並據此把蛋白質結構分為四類:α型、β型、α / β型以及其它類型的結構域結構。α型結構域結構主要由α-螺旋所構成,例如肌紅蛋白的結構等。β型結構域結構主要由反平行的卜回折所構成,通常是兩個卜回折相互包裹在一起,例如質體蘭素的結構等。α / β型結構域結構則是由α-螺旋所包裹的以平行β-鏈為主的;β-α-β花樣所構成的,例如丙糖磷酸異構酶、葡萄糖異構酶催化結構域的結構等。還有一些蛋白質是由不連續的α-和β-花樣組合而成,並且通常在由α-螺旋包裹的結構域的一部分形成一個小的反平行β-回折,這些結構可以認為屬於第四類,例如某些核酸酶的結構等。此外還有一些小的蛋白質,它們富含二硫鍵或金屬離子,形成一個特殊的種類,這些蛋白質的結構似乎在很大程度上受金屬離子或二硫橋的影響,所以看起來比常規的蛋白質顯得無序。
類型有:α-螺旋型;α/β型;全β-摺疊型;無規卷型。
性質
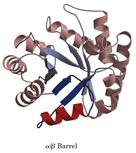 結構域
結構域又稱基元。蛋白質分子的一種摺疊單位,是較大的蛋白質分子或亞基三維摺疊中的一個層次或一種相對獨立的三維實體。一條長鏈多肽鏈最後一步摺疊就是結構域締合(association),而成一個有活性的蛋白質分子或亞基。在一級(維)結構中的胺基酸序列的某些區域相鄰的胺基酸殘基形成有規則的二級(維)結構(如α-螺旋、β-摺疊、β-轉角和無規捲曲等);然後再把相鄰的二級結構片段集裝在一起,形成超二級結構;在此基礎上,多肽鏈再進一步摺疊,或為近乎球狀的三維(級)結構而成(一個)結構域。對於一個較大球狀蛋白質分子來說,一條龐大的多肽鏈往往由兩個或兩個以上相對獨立的三維實體締合而成三維結構體。最常見的結構域約含有100~200個胺基酸殘基,一般至少40個、多的可至400個以上;對於較小的蛋白質分子或亞基,“結構域”和“三級結構”往往是一個概念,也就是說,這些蛋白質是屬於單結構域分子(如卵溶菌酶等)。從功能角度看,很多屬於多結構域的酶蛋白,其活性中心都位於結構域之間,這是基於:(1)通過結構域容易構建具有特定三維排布的活性中心;(2)結構域之間常只有一段肽鏈相連,使域間容易發生相對運動,這將有利於活性中心結合底物或施加應力,有利於別構中心結合調節物和發生別構效應,以利於酶對反應的催化。
結構域實質上是二級結構的組合體,充當三級結構的構件。每個結構域分別代表一種功能。
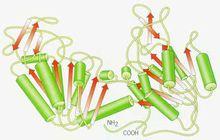 結構域
結構域有些球形蛋白的一條肽鏈,或以共價鍵相連的兩條或多條肽鏈在空間結構上可以區分為若干個球狀的子結構,其中的每一個球狀子結構就被稱為一個結構域。同一個蛋白的各個結構域之間是以肽鏈相互連結的,而連結兩個結構域的絕大多數都是單股肽鏈,只有在極個別的情況下會有少數的雙股肽鏈聯繫不同的結構域。在X-射線衍射實驗繪製的電子密度圖中,可以清楚地看到有些球狀蛋白地的部存在一些裂隙,這些裂隙就是各個結構域之間的連結部分,結構域之間的連結雖然是鬆散的,但他們仍然屬於同一條肽鏈,靠肽鏈連結這一點和蛋白質的各個亞基之間依靠非鍵相互作用維繫結構有著本質的區別。
結構域在空間上具有臨近相關性即在一級結構上相互臨近的胺基酸殘基,在結構域的三維空間結構上也相互臨近,在一級結構上相互遠離的胺基酸殘基,在結構域的空間結構上也相互遠離,甚至分別屬於不同的結構域。
結構域與蛋白質完成生理功能有著密切的關係,有時幾個結構域共同完成一項生理功能,有時一個結構域就可以獨立完成一項生理功能,但是一個結構不完整的結構域是不可能產生生理功能的。因此結構域是蛋白質生理功能的結構基礎,但必須指出的是,雖然結構域與蛋白質的功能關係密切,但是結構域和功能域的概念並不相同。
舉例
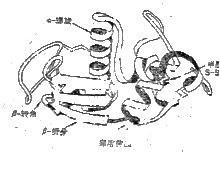 結構域
結構域乳酸脫氫酶有2個結構域免疫球蛋白(Ig)有12個結構域[VL(輕鏈的變區)、CL(輕鏈的恆區)、VH(重鏈的變區)、CH1(重鏈的恆區1)、CH2(重鏈的恆區2)、CH3(重鏈的恆區3)各2個]。其中可變區決定了Ig的特異性,而Ig的其它生物學性質,如免疫原性、穿過胎盤、結合補體(或巨噬細胞的吸附)等作用則由恆區決定。
形成:結構域之間的結構比較鬆懈,常形成裂隙或洞穴裂隙內有許多非極性胺基酸殘基,因而是疏水的,不允許水分子進入,但能容鈉蛋白質的輔基或酶的底物分子等。
意義:蛋白質的活性部位或變構結構部位多位於裂隙處。由於結構域之間連線的柔韌性,每個結構域可進行較大幅度的相對運動,使裂隙開放或關閉,便於蛋白質分子與其他分子之間的相互作用,故這些部位往往是活性中心所在的部位,或是變構物結合的部位。
區別
 結構域
結構域模體(motif)即超二級結構,簡言之,就是二級結構有規律的組合。例如螺旋-環-螺旋,貝塔摺疊的組合、阿而法螺旋組合等。再比如亮氨酸拉鏈、鋅指結構都是典型的模體,它們執行一定的功能,即模體既是結構的單位,又是功能單位,他們可直接作為結構域和三級結構的建築塊。某些蛋白質因子與DNA大溝結合的部位靠的就是某些特異的模體。 結構域(domain)是指在較大的蛋白質分子中形成的某些在空間上可以辨別的結構,往往是球狀壓縮區或纖維狀壓縮區。它們也既是結構單位,又是功能單位。例如免疫球蛋白的功能區就是結構域。顯然模體與結構域是不同的概念。
![Domain[結構域] Domain[結構域]](/img/b/328/nBnauM3X0MTMxQzNzAjN3UzM1UTM1QDN5MjM5ADMwAjMwUzLwYzLyMzLt92YucmbvRWdo5Cd0FmLwE2LvoDc0RHa.jpg)
