如何形成
溶解與結晶
以固體溶質在水裡的溶解過程來講,當固體溶質放到水裡時,固體表面的微粒(分子或離子)由於本身的振動和水分子的吸引作用,便漸漸地離開固體表面進入水分子之間,並通過擴散作用,均勻地分散到水的各個部分,這個過程叫做溶解。
與此同時,溶液中還進行著另一個相反的過程,就是那些已經溶解的溶質微粒(分子或離子)在溶液中不斷運動。其中有些溶質微粒當碰到尚未溶解的固體表面時,又被吸引住而重新回到固體表面上來,這個過程叫做結晶。
顯然,結晶與溶解是相互對抗的,它們是物質溶解整個過程中的一對矛盾。在開始時,溶液里溶質的分子(或離子)數很少,結晶速度比溶解速度要小得多,溶解成為矛盾的主要方面,整個過程表現為固體溶質在不斷地溶解。但隨著固體的不斷溶解,溶液里溶質分子(或離子)數漸漸地增多,則結晶速度也增大。
平衡建立
 飽和溶液
飽和溶液這樣,必將會達到結晶速度與溶解速度相等,即在單位時間內從固體上進入溶液中的分子(或離子)數和從溶液中返回到固體上的分子(或離子)數相等。此時,在表面上看來溶解過程似乎停頓了,而實際上只是“固體溶質”的溶解與“溶液中的溶質”的結晶,成了動態平衡,即:
右式的這種狀態,叫做溶解平衡。這種狀態下的溶液,就叫做飽和溶液。飽和溶液是能與過量的溶質成平衡狀態的溶液。通常情況下,飽和溶液這個名詞也可以這樣講:在一定溫度下,不能再繼續溶解某種溶質的溶液,叫做這種溶質的飽和溶液。反之,還能繼續溶解某種溶質的溶液,叫做這種溶質的不飽和溶液。
在這裡要注意的是,不要認為飽和溶液一定很濃,或者不飽和溶液一定很淡。對於同一種溶質的溶液,我們說,在一定溫度下,它的飽和溶液總要比不飽和溶液濃些,那是完全正確的。但是對不同溶質的溶液,就不能這樣講了。因為,從飽和溶液和不飽和溶液的定義來看,溶液是飽和還是不飽和,關鍵在於它能不能繼續溶解溶質,而不在於溶液的濃或淡。由於各種物質的溶解能力不同,有些物質的溶解能力很小,即使它的飽和溶液,仍然是很淡的。例如熟石灰,在20℃時,在100克水裡最多只能溶解0.165克。這已是一種飽和溶液,但它是很淡的溶液。與此相反,有些物質的溶解能力很大,即使它的溶液已是很濃,也還不一定是飽和溶液。
製取方法
通過以下方式可以使不飽和溶液變為飽和溶液:
增加溶質至溶質有剩餘;
蒸發溶劑(可用蒸發法,最好為恆溫蒸發,要看到有晶體析出);
降低溶劑溫度至有晶體析出。(註:少部分溶液則相反,溶劑溫度越高它們的溶解度越低)
1.增加溶質至溶質有剩餘;
2.蒸發溶劑(可用蒸發法,最好為恆溫蒸發,要看到有晶體析出);
3.降低溶劑溫度至有晶體析出。(註:少部分溶液則相反,溶劑溫度越高它們的溶解度越低)
通過以下方式可以使飽和溶液變為不飽和溶液:
升高溶液溫度;(註:此轉化條件僅適用於溶解的最大量隨溫度升高而增大的固體物質)
增加溶劑。
1.升高溶液溫度;(註:此轉化條件僅適用於溶解的最大量隨溫度升高而增大的固體物質)
2.增加溶劑。
溶解度曲線
溶液有不飽和、飽和、過飽和三種情況。溶液的這三種情況,還可以從溶解度曲線上看出來。溶解度曲線是反映溶解度和溫度間關係的一種數學表示法。曲線上的任意一點從數量上看是表示在某一溫度下某種溶質的溶解度。同時也表示這時的溶液已經達到了平衡狀態,也就是說已經成為這個溫度下的飽和溶液。
從溶解度曲線看溶液的飽和程度
 飽和溶液
飽和溶液 飽和溶液
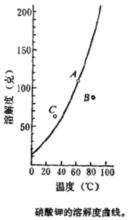
飽和溶液右圖是硝酸鉀的溶解度曲線。在這條曲線上的一點A,表示在60 的時候,100克水裡溶解了110克硝酸鉀,得到硝酸鉀在這個溫度下的飽和溶液。這時候溶液里如果還有沒有溶解的溶質存在,那么它和已經溶解的溶質之間就處在動態平衡狀態,所以A點表示:溶質處在固液兩相的平衡狀態,也叫做穩定狀態。
在曲線右下方面積上的任何一個點都和曲線上的點有不同的含義。如B點就表示在80的時候100克水裡溶解了90克硝酸鉀。不過這時候的溶液並不是飽和溶液,如果往溶液里再加一點硝酸鉀溶質,它還可以繼續溶解。也就是說,曲線右下方面積上的每一個點都表示溶液處在不飽和溶液狀態,這時候溶液里不會有沒有溶解的溶質存在,只有一個液相,是單相體系。因為這種溶液還可以繼續溶解相同的溶質,所以這種溶液是不穩定的,這種狀態叫做不穩定狀態。
在曲線左上方面積上的點表示溶液里所溶解的溶質的數量超過了在這個溫度下這種溶質的溶解度,說明這種溶液是過飽和溶液。過飽和溶液極容易析出晶體而變成飽和溶液,這樣就轉入了穩定狀態。
判斷是否飽和
1. 有固體剩餘物;
2. 取一定量溶質加入該溶液攪拌後不再溶解。
過飽和溶液是指溶液中所含溶質的量大於在這個溫度下飽和溶液中溶質的含量的溶液(即超過了正常的溶解度)。溶液中必須沒有固態溶質存在才能產生過飽和溶液。
製取過飽和溶液,需要在較高的溫度下配製飽和溶液,然後慢慢過濾,去掉過剩的未溶溶質,並使溶液的溫度慢慢地降低到室溫。這時的溶液,它的濃度已超過室溫的飽和值,已達到過飽和狀態。
相關概念
溶液
溶液:一種或一種以上的物質以分子或離子形式分散於另一種物質中形成的均一、穩定的混合物。上文提到,濃溶液不一定是飽和溶液,稀溶液不一定是不飽和溶液,但同種溶質,飽和溶液一定比不飽和溶液濃度大。
按聚集態不同分類:
•氣態溶液:氣體混合物,簡稱氣體(如空氣)。
•液態溶液:氣體或固體在液態中的溶解或液液相溶,簡稱溶液(如鹽水)。
•固態溶液:彼此呈分子分散的固體混合物,簡稱固溶體(如合金)。
溶液的理化特性為:
•均一性:溶液各處的密度、組成和性質完全一樣;
•穩定性:溫度不變,溶質,溶劑量不變時,溶質和溶劑長期不會分離(透明);
•混合物:溶液一定是混合物。
溶解度
在一定的溫度和壓強下,在一定量的某一種溶劑里所能溶解的某一種溶質的最大限度量,也就是形成飽和溶液的時候一定量的溶劑里所含的溶質量,叫做這種溶質在這種溶劑里的溶解度。
溶解度通常用100克溶劑里的溶質量來表示。在這裡要注意:是100克溶劑而不是100克溶液。
溶解速度
溶解速度就是每個單位時間裡溶質進入溶液里的量。
有的物質溶解度大,溶解速度也快;有的物質溶解度小,溶解速度也慢。例如,容易溶解的蔗糖比難溶的石膏溶解速度快。即使都是容易溶解的,溶解度比較小的食鹽的溶解速度也比溶解度大的蔗糖慢。這都是由物質的本性不同而引起的。
除此之外,也還有一些因素影響物質的溶解速度。
固體溶質顆粒的大小對溶解速度也有比較大的影響。因為固體的溶解只能在固液兩相的界面處進行,而粉碎可以增加溶質和溶劑的接觸面,因此溶質粉碎程度越大,溶質的表面積就越大,溶解速度也就越大。
攪拌或者搖動也可以加快溶解速度。因為溶解了的溶質微粒在離開固體溶質後的擴散速度是相當慢的,這就使固液兩相界面處的溶質的濃度最大,並且很快就接近了飽和濃度。要想使新的溶質繼續溶解,就必須使飽和層的溶質擴散出去。但是,自動擴散是比較緩慢的過程,因此,在靜置狀態下溶解是緩慢的。如果加以攪拌,就可以加速擴散過程,促使不飽和的那部分溶液和溶質接觸,這就增大了溶解速度。
加熱可以使溶質和溶劑微粒的運動速度加快,並且能引起對流,因此也能起到攪拌或者搖動相同的效果。但是必須說明的是,加熱同時還可以使溶解度改變,而攪拌或者搖動卻並不影響溶解度。
在實際工作中,常用粉碎溶質、加熱、攪拌或者搖動這三種手段來加快固體的溶解速度,以達到提高工作效率的目的。
過飽和溶液和不飽和溶液
在一定溫度下溶液里的某種溶質超過這種溶質的飽和限度的溶液,叫做這種溶質的過飽和溶液。在溶質溶解量沒有達到最大限度之前所形成的溶液,都叫不飽和溶液。
飽和溶液里所含的溶質多少,和哪些因素有關呢?
一是溶劑的種類,二是溶質的種類。溶劑不同,或者溶質不同,飽和溶液里所含的溶質量也不同。三是溶劑的量。同一溶質溶解在同一溶劑里,溶劑越多,當然飽和溶液里含的溶質越多。所以我們常常說明在一定量的溶劑里。四是溫度。溫度不同,同一溶質在一定量的同一溶劑里,飽和溶液里含的溶質質量也不同。五是壓強。對於固體和液體溶質來說,壓強的影響不大。對於氣體溶質來說,壓強的影響卻很大。
相關知識
在一定溫度下溶液里的某種溶質超過這種溶質的飽和限度的溶液,叫做這種溶質的過飽和溶液。過飽和溶液是不穩定的,如果攪拌溶液、使溶液受到震動、摩擦容器器壁、或者往溶液里投入固體“晶種”,溶液里的過量溶質就會馬上結晶析出。結晶之後,剩下的母液就是跟溶質晶體處在平衡狀態的飽和溶液。
過飽和溶液是一種不穩定的狀態,它能夠存在的原因是:這種溶液中溶質不容易形成結晶中心(叫晶核)。要結晶,必須在溶液中形成結晶中心,才能使溶液中溶質質點在結晶中心周圍按次序排列集合成晶體析出。

