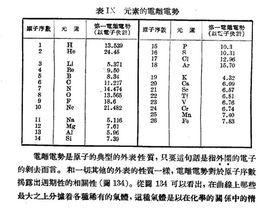
概念
當電子與原子碰撞時,如果加速電子的能量大到足以把原於內的電子撞擊出去,使原子變成正離子,這時用以加速電子的電勢就稱為電離電勢。原子基態的電離能(把一個電子從基態的軌道上移到離核無限遠處所需要的能量)也稱為電離電勢。例如,氫的電離能等於13.59765±0.00022電子伏。
勒納首先在1902年進行測定電離電勢的實驗。後來夫蘭克—赫茲加以改進,並重新測定許多原子的電離電勢。
特點
電離是電解質在水溶液或熔融狀態下生成自由移動陰陽離子的過程。將電子從基態激發到脫離原子,叫做電離,這時所需的能量叫電離電勢能。 例如氫原子中基態的能量為-13.6eV(電子伏特),使電子電離的電離勢能就是13.6eV(即2.18×10-18焦耳)。
原子是由帶正電的原子核及其周圍的帶負電的電子所組成,由於原子核的正電荷數與電子的負電荷數相等,所以原子是中性的.原子最外層的電子稱為價電子.所謂電離,就是原子受到外界的作用,如被加速的電子或離子與原子碰撞時使原子中的外層電子特別是價電子擺脫原子核的束縛而脫離,原子成為帶一個或幾個正電荷的離子,這就是正離子.如果在碰撞中原子得到了電子,則就成為負離子。
電離電勢是化學元素的重要特徵,因為原子軌道上電子的阻留強度在很大程度上決定這些元素的化學性質;了解它能夠較深刻地理解化合物分子中和品格中電子云密度的分布特點。
在每個周期里,電離電勢在增長,遵守某些複雜的定律:最低值I是鹼金屬的特徵,其原子核在自己的周期範圍內具有最小的電荷,所以吸引(單)一的價電子能力小;元素最高的電離電勢是第八族元素(隋性氣體),它們在自己的周期里原子核電荷最多。
測定方式
 電離電勢測量示意圖
電離電勢測量示意圖如果給予原子足夠大的能量,可以使原子中的電子離去,可稱為電離。經電場加速的電子與原子相碰時,剛好能夠使原子電離,這時的電勢差稱為電離電勢。對電離電勢的測量裝置如右圖所示。
在一容器中,裝有幾個電極。圖中的K是發射電子的熱陰極,G是圓柱形的金屬網,外面套一個圓柱形的陽極A圓柱網上、下各有一個平底,其下底的中央開有一小孔,並蓋有一層金屬網G。在G的外側有一熱陰極K,可以發射電子。G極與K極之間維持一定的電壓,而G極與以極為等電位。將容器中的空氣抽出,充入被研究的氣體,並達到適當的氣壓。
實驗分兩步進行:首先在KG間維持一固定的電壓。逐漸增加K極的電子發射量,觀察KG間電流的變化情況。從電流計的示數可以看出。起初電流是上升的,後來就停止增加了。這是由於KG間電壓是固定的,儘管K極發射電子量較大,但不能很快向A極疏散,使得K極周圍積存有大量電子,從而限制了K極電子的發射,因此發射量不能再增加。
這時進行實驗的第二步,在KG間加電壓,並逐漸由小變大,於是K極發射的電子被加速而通過金屬網G,進入GG空間。開始時,對KG間電流不會產生什麼影響。但當KG間電壓達到一定數值時,KG間電流會突然上升。引起這種情況的原因是由於KG間電壓達到氣體的電離電勢時,通過G的電子與氣體的原子相碰而使之電離,產生正離子和電子。在GG網內的空問中,G極對K極的電位為正,電子引向G極,而正離子則移向K極,並與K極附近的電子中和,因而減少了對K極電子發射的限制,使得電子發射量增加,於是KG間電流也隨之增加。這樣,KG電流突然增加,就表示有電離發生,也就是KG間的電勢差已達到氣體電離電勢。使用這種方法可測量出許多種原子的電離電勢,但是原子的電離電勢也可以從光譜的實驗中推算出來。
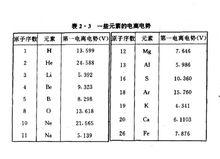 一些元素的電離電勢
一些元素的電離電勢把中性原子中的一個電子電離所需要的電壓稱為第一電離電勢。
各種元素具有一定的電離電勢這一事實表明:從原子的基態到電離狀態的能量差是一定的,這也是原子內部能量量子化的一個有力證明。