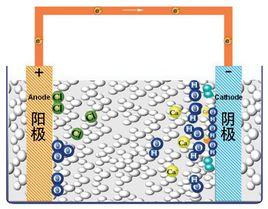
概述
電極-電解質系統是化學能與電能互相轉化的一種電化學反應器。如果自發地將化學能變成電能,這種電極-電解質系統稱為原電池;如果實現電化學反應的能量由外電源供給,則這種電極-電解質系統稱為電解池。原電池將化學能轉變為電能,電解池將電能轉變成化學能。每個電極-電解質系統都由兩個稱之為電極的導體和與之接觸的電解質溶液構成。一支電極和與其相接觸的電解質溶液構成一個半電池,兩個半電池構成一個電極-電解質系統。
 電極-電解質系統
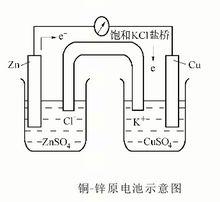
電極-電解質系統在電極-電解質系統中,發生氧化反應的電極稱為陽極,發生還原反應的電極稱為陰極。在右圖所示的銅-鋅原電池中,陽極和陰極上發生的氧化還原反應如下:
陽極(鋅極、負極): Zn-2e→Zn
陰極(銅極、正極):Cu +2e→Cu
原電池的總反應為:Cu +Zn→Cu+Zn
若外加電壓大於原電池的電動勢,則銅-鋅原電池變成電解池:
陽極(銅極、正極):Cu-2e→Cu
陰極(鋅極、負極):Zn +Cu→Zn
電解池的總反應為:Zn +Cu→Zn+Cu
上述反應是銅鋅原電池反應的逆反應。顯然,原電池的電池反應自發進行;電解池的電池反應不能自發進行。在電位法中使用的測量電池均為原電池 。
電極
電極-電解質系統中兩個電極可以稱為陽極和陰極。它們劃分依據是:凡是發生氧化反應的電極稱為陽極,凡是發生還原反應的電極稱為陰極。因此,原電池正極是陰極,負極是陽極。套用時應加以注意,一般原電池的電極常稱為正、負極,而電解池和腐蝕電池的電極常稱為陰、陽極 。
可逆與不可逆系統
電極-電解質系統可分為可逆電池和不可逆電池兩種。可逆電池系統滿足以下要求:
(1)在電池構造方面,構成電池的兩極必須是可逆的,即有相反方向的電流通過電極時所進行的電極反應必須恰好相反。
(2)在工作條件方面,電池無論是放電或充電時,都要在電流極微小的條件下進行即同一電勢下進行 。