概述
藥物在體內要經過吸收、分布、代謝和排泄,才能完成藥物發揮藥效的過程。在此過程中,許多環節都與酶和受體的作用密切相關。倘若決定這些酶或受體蛋白的基因出現變異或缺陷,必將導致藥物代謝發生異常反應。因此,有必要深入了解遺傳變異對藥物反應的影響及其分子基礎,並據此預測對藥物異常反應的個體,從而進行有效的防治。對藥物遺傳學的研究,已揭示了許多藥物異常反應的遺傳基礎和生化本質,這對於指導臨床醫生正確掌握用藥的個體化原則,防止各種與遺傳有關的藥物反應都具有指導價值。
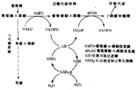 藥物遺傳學
藥物遺傳學藥物遺傳學(pharmacogenetics)是生化遺傳學的一個分支學科,它研究遺傳因素對藥物代謝動力學的影響,尤其是在發生異常藥物反應中的作用。臨床醫生在使用某些藥物時,必須遵循因人而異的用藥原則。因為在群體中,不同個體對某一藥物可能產生不同的反應,甚至可能出現嚴重的不良副作用,這種現象稱為個體對藥物的特應性(idiosyncracy)。特應性產生的原因相當部分取決於個體的遺傳背景。
藥物反應的個體差異是臨床實踐和藥物發展的主要問題,它能導致治療失敗或ADR。對美國39所醫院的預期分析研究表明,6.7%的住院病人曾發生過嚴重ADR,其中0.32%是致命的,ADR導致了美國每年100,000人死亡,是住院病人第四至第六大死亡原因。是什麼決定了個體發生ADR的風險?這種藥理變化有多少能被預測?藥物的不良反應有多少能被預防?這些將是這篇綜述中所涉及的問題。
藥物低效或毒性的潛在危險因素包括藥物相互作用、病人的年齡、肝腎功能或其它疾病,以及生活習慣如吸菸、酗酒等,其中更重要的因素是影響藥效學和藥動學的許多遺傳性因素,因此,藥物代謝酶、藥物受體和藥物轉運基因的遺傳學差異與個體藥效和毒性的變化有關。此外,區別環境因素和遺傳因素對個體的作用很難,遺傳和環境因素的主要區別在於遺傳性突變或特徵終身存在,在一生中只需檢測一次,而環境因素則持續發生影響。如果在正常人群中基因突變發生頻率大於1%,則為基因多態性。基因多樣性解釋了為什麼少數人存在著發生ADR的高風險,目前這方面的研究已發展到藥物遺傳學領域。
簡史
人們很早就發現有些人對某些藥物(如抗瘧藥等)異常敏感,服用常規劑量便出現異常藥物反應(如發生皮疹、溶血等)。藥物遺傳學始於二十世紀五十年代,當時研究者發現有些ADR是由決定酶活性的基因改變引起的。例如給予琥珀醯膽鹼後肌松作用延長是由於先天性血漿膽鹼酯酶缺乏;抗瘧藥引起的溶血被認為是由於遺傳性6-磷酸果糖脫氫酶變異;某些人先天性乙醯化異煙肼能力的改變是其發生周圍神經病變的原因。在給予抗心律失常藥和催產素金雀花鹼後,病人出現的眩暈、復視、視物模糊以及抗高血壓藥異喹胍後引起的非容量性直立性低血壓,對這種情況的深入研究導致了藥物代謝酶細胞色素P4502D6(CYP2D6)基因多態性的發現,見表1。因此,基因多態性是通過對一些病人或志願者接受標準劑量藥物後出現偶然性的不良反應的觀察而發現的。1957年A·G·莫圖爾斯基首先指出某些異常的藥物反應與遺傳缺陷有關。1959年T·福格爾正式提出藥物遺傳學這一名稱。1962年W·卡洛發表了與藥物遺傳學有關的著作。1973年世界衛生組織發表了關於藥物遺傳學的技術報告,綜述了藥物遺傳學的基本內容。
研究內容
 藥物遺傳學
藥物遺傳學藥物遺傳學的主要研究內容是異常藥物反應的遺傳基礎。單基因遺傳在引起藥物反應個體差異的多種因素(包括生理狀態、性別、年齡、遺傳、環境因素等)中,遺傳因素起主要作用。遺傳因素引起的異常藥物反應實質上就是遺傳缺陷對藥物在機體內代謝過程或對藥物效應的影響。許多異常藥物反應是某一種酶的缺陷的結果,為單基因所控制,按孟德爾定律,遺傳受環境因素的影響較少。例如抗結核藥異煙肼在體內必須先在N- 乙醯基轉移酶的作用下經乙醯化而失去活性後才經腎臟排泄。
人類群體中的不同個體可區分為失活快型與失活慢型兩種類型。失活快型的肝細胞內有N- 乙醯基轉移酶,能將異煙肼迅速乙醯化並排出體外,異煙肼半衰期短,約45~110分鐘。失活慢型的肝細胞內缺乏N- 乙醯基轉移酶,口服異煙肼後血液中保持藥物的時間較長,異煙肼半衰期可長達4.5小時。失活慢型反覆給予異煙肼後容易引起蓄積中毒,發生周圍神經炎。失活快慢之間的差異和腸的吸收、蛋白質結合、腎小球的清除及腎小管的重吸收無關,而和肝細胞內的N- 乙醯基轉移酶的含量有關,這一藥物反應為單基因控制。系譜調查結果證明異煙肼失活緩慢屬於常染色體隱性遺傳,白種人與黑種人中約60%屬於此型,黃種人中只占 10~20 %。中國台灣省、香港地區居民以及新加坡的華裔中都占22 % 左右。
另一種較為常見的單基因控制的遺傳性藥物異常反應是葡萄糖- 6- 磷酸脫氫酶(G6PD)缺乏症。G6PD在紅細胞戊糖代謝途徑中有重要作用,它催化6- 磷酸葡萄糖的脫氫反應,氫經輔酶Ⅱ傳遞給谷胱甘肽(GSSG)使成為還原型谷胱甘肽(GSH),GSH有保護血紅蛋白兔受氧化的作用,同時對含—SH基的酶和紅細胞膜蛋白的—SH基也有保護作用。G6PD缺乏症患者的酶活性降低,GSH減少,服用伯氨喹啉等有氧化作用的藥物後,GSH進一步減少,從而導致血紅蛋白氧化變性形成亨氏小體,有亨氏小體的紅細胞膜脆性增加,通過脾竇狹窄通道時易破裂而溶血。
G6PD缺乏症存在多種變異型,目前已發現 190多種。系譜調查表明由G6PD缺乏引起的溶血性貧血屬於X連鎖不完全顯性遺傳。G6PD缺乏症的分布是世界性的,特別是非洲與美洲黑人和地中海沿岸國家的居民發生率較高。在中國華南、西南地區的發生率也較高,尤其是廣東省的一些漢族集居區常可高達8.6%。
多基因遺傳藥物被攝入體內後,經過吸收、運轉而到達作用部位。某些藥物在體內還必須和某些細胞的受體發生相互作用才能在體內參與或干擾某些特定的代謝作用。所以一般藥物的代謝往往是受多基因控制的。
根據雙生兒法研究結果,多種受多基因遺傳控制的藥物半衰期的遺傳度相當高,例如保泰松和乙醇的血漿半衰期的遺傳度是0.99、安替比林是0.98、雙香豆素是0.97。包括保泰松、洋地黃毒苷、地高辛、利多卡因、普魯卡因醯胺、奎尼丁和水楊酸鹽等在內的許多藥物的代謝都屬於多基因控制類型。
套用
 藥物遺傳學
藥物遺傳學藥物使用應當因人而異。在同樣攝取標準劑量的藥物之後,有些人由於藥物代謝快,血漿中藥物濃度過低而療效不佳,大多數人藥物代謝正常,血漿中藥物達到有效濃度而有顯著藥效;也有些人由於藥物代謝慢,血漿中藥物濃度過高,有可能出現中毒症狀。所以使用藥物時應根據患者的遺傳特點,建立藥物使用個體化原則,這樣可以提高藥效,減少或避免發生不良的藥物反應。
對於有藥物代謝遺傳缺陷家族史的人,在使用敏感藥物時應慎重從事,例如對有G6PD缺乏症家族史的人使用抗瘧藥、解熱止痛藥和磺胺類藥時應預先檢查其G6PD活性,以免引起溶血反應。對有因藥物而引起惡性高熱家族史的人,在使用麻醉劑前應檢測其血清中磷酸肌酸激酶(CPK)的活性,避免發生麻醉意外。根據藥物遺傳的特點,還可以檢出臨床前型的病人。如在用地塞米松為就診者點眼時,如果發現眼壓升高,那就說明就診者可能是青光眼患者或青光眼的臨床前型。
藥物遺傳學的研究歷史不長,雖然對一些明顯的單基因遺傳的藥物遺傳性狀研究得比較多,但對於一些常用藥(如強心藥、解熱止痛藥等)的代謝特點還缺乏系統的藥物遺傳學研究。
基因型和表型
 醫學藥物遺傳學
醫學藥物遺傳學在過去的十年中,分子遺傳學和人類基因組學使藥物遺傳學發生了變革。現能在DNA水平上描述在個體特定基因位上的一對等位基因(即基因型)的特徵。它們對藥物動力學或受體功能的影響(即表型)能通過先進的代謝探測分析方法或臨床觀察來揭示,如以陽離子段層攝影術研究受體密度。藥物遺傳學的分子研究始於對CYP2D6的克隆和描述,現已擴大到許多其它的人類基因,包括編碼20多種藥物代謝酶、受體以及藥物轉運系統的基因。
目前已研究了超過70個CYP2D6位點的變異等位基因。由於一個或多個位點的突變,這些等位基因不同於正常基因(野生型)。這種突變的結果是多樣的,有的對酶的活力沒有影響,有的使酶活力降低或失活,而複製導致酶活性增強。廣義代謝被定義為野生型的純合子或雜合子個體(人群的75-85%),兩個低活力等位基因為中間代謝(10-15%),功能缺失等位基因為低代謝(5-10%),二重或多重活性基因具有超速代謝(1-10%)。儘管從總體上突變的數量和複雜性很大,但仍有一些突變基因(通常3-5個等位基因)是常見的,它們占了突變總量的95%以上。運用基因晶片等現代DNA技術可以方便地檢測這些等位基因,並依此劃分病人的基因型。
CYP2D6仍然是研究最多的多態性基因之一,以此建立的相同方法用於許多其它基因的研究。低代謝表型通常以正常隱性染色體遺傳,所以多態性基因中,低代謝型應該是一對突變的等位基因。這種情況適用於單基因性狀,即一個基因主要影響表型,並將人分成兩至三個不同群體。然而對許多藥物的反應往往不是由單一基因決定的,而是由多基因產物(影響藥物性質和藥物作用等)的相互之間的綜合作用決定的。與單基因性狀相比,多基因遺傳更難從眾多環境因素中檢測並區分出來。它的分析與複雜疾病相似,例如癌症、精神疾病、關節炎、哮喘等是由原發基因、基因修飾和環境因素相互作用和相互影響而形成的。
一個簡單的區分遺傳和環境因素的方法是比較一些單卵雙生和雙卵雙生的雙胞胎的情況,或者在個體間反覆給藥並比較其反應的不同。運用這一方法人們揭示了藥物(如雙香豆素、氟烷、苯妥英、甲苯磺丁脲、咪唑安定)在藥動學諸多方面中的許多重要遺傳因素。
將來這項基於基因組的新技術將有效地促進藥物遺傳學特徵的發現,快速測序和單個核苷酸多態性(SNPs)將把個體差異和遺傳性臨床表型聯繫起來。比較兩個不相關的個體可以發現SNPs在每100-1500個鹼基中發生一次,而單個整組基因約有三億對鹼基,所以任何兩個個體都有大約3百萬個基因不同,占三億對鹼基的0.1%。通常SNPs發生頻率大於1%或更大(大於10%)。當我們掌握了這些SNPs的數量和頻率,我們就可以將一個病人的基因“圖譜”和可能的個體藥物反應聯繫起來,從而做到個體化給藥。SNPs在基因編碼區(大約每個基因組30000-100000)能引起胺基酸改變和蛋白質功能改變,這種改變可能影響藥物反應。總之,在基因的基礎上預測個體間藥效或毒性差異將成為將來藥物治療的一個現實方案。
藥物遺傳學的人口差異
資料顯示,藥物遺傳學差異的發生頻率在不同人種、地域中是不同的。以異煙肼為例,由CYP2C9和CYP2C19突變引起的N-乙醯化轉移酶2低代謝可以引起異煙肼緩慢乙醯化,而CYP2D6突變將引起的超速代謝,其發生頻率存在重要的種族間差異。這些基因的一些突變僅僅發 生在某一種族區域人口中,這種種族分布也稱作“基因地理學”,提示種族因素在藥物 遺傳學和藥物治療研究中必須考慮。
治療問題
總體上,三種藥物遺傳學機制影響藥物治療。首先,研究得最早和最多的是與藥物代謝有關的基因多態性,如三環類抗抑鬱藥能增強或減弱藥物代謝,改變藥物濃度。第二,基因改變能產生不期望的藥 物作用,例如G-6-P-D缺乏引起溶血。第三,藥物靶位的基因改變能改變藥效以及不良反應發生頻率,如β-腎上腺素受體變化能改變哮喘病人對β-腎上腺素的反應。
基因多態性與藥物治療是否相關主要決定於藥物的特點。藥物的代謝酶、攝取機制的量化以及治療窗將決定在低代謝和超速代謝人群中需要如何調節劑量。CYP2D6的多態性就是如此。對90%的病人來說,去甲替林的劑量75-150mg/d(穩態血濃200-600nmol/L),但是低代謝型病人只要10-20mg/d就可達到同樣的濃度,而超速代謝型病人則需要300-500mg/d或更多才能達到同樣的血藥濃度。顯然,如果不知道病人的基因型或表型,低代謝病人將會因相對劑量過大而面臨毒性反應的高風險,而對超速代謝型來說則劑量不足。另一種情況是藥物的活性代謝產物(如嗎啡是可待因的活性產物)發揮其治療作用。因此,同樣的藥物在低代謝型上將沒有藥效,而在超速代謝型上將出現藥效強
在臨床上需要測定基因多態性的藥物與需要進行藥物濃度監測的情況相似,如治療窗窄或個體差異較大,所不同的是具有極端表型的病人一生中進行藥物遺傳學的一次DNA檢測就足夠了。
基因多態性影響藥物動力學和藥物毒性的例子
藥物代謝
已知大約50-100種藥物代謝酶具有普通基因多態性。表3列出了一些已被證實的重要的藥物反應的臨床差異。CYP2D6三環類抗抑鬱藥安普洛托品、氯米帕明、地昔帕明、米帕明和去甲替林,四環類的馬普替林、米安舍林的代謝不同程度地受CYP2D6多態性的影響。因此,臨床上病人對這些藥物的反應會有所不同。當給予正常的推薦劑量時,三環類抗抑鬱藥在低代謝型的血藥濃度會偏高,而超速代謝型因血藥濃度太低易於治療失敗。研究發現5-20%的病人屬於這種易感人群。很顯然,不良反應更多發生在低代謝型上,並且這種反應常被誤認為是抑鬱症狀,從而導致了進一步加大劑量的錯誤。
除了抗抑鬱藥,許多其它精神病藥物也受CYP2D6多態性的影響。抗抑鬱藥文拉法辛的代謝受CYP2D6的控制,低代謝型的口服清除率顯著降低,進而其心血管毒性明顯增加。另一類抗抑鬱藥是選擇性5-羥色胺重吸收抑制劑,它通過三種不同的方法與CYP2D6相互作用。帕羅西汀、氟伏沙明、氟西汀由CYP2D6部分代謝,這種部分代謝對血藥濃度的改變並不很大。然而,特別重要的是它們是CYP2D6強效競爭性抑制劑,可以影響到其他CYP2D6酶的底物(如三環類抗抑鬱藥)的清除,因此如果聯合給予5-羥色胺選擇性重吸收抑制劑,異喹胍、金雀花鹼、右美沙芬等藥物的代謝表型將出現假陽性結果,也就是低代謝型。這種藥物相互作用僅僅與藥物的強代謝型有關,西酞普蘭、氟伏沙明、舍曲林不具有這種抑制特徵而不會導致CYP2D6-特異性的藥物相互作用。氟伏沙明是CYP1A2的底物也是其強抑制劑,所以它和由CYP1A2代謝的藥物(如阿米替林、氯丙咪嗪、丙咪嗪、氯氮平、茶鹼)存在相互作用。因此,藥物代謝基因多態性對抗精神病藥物頗有影響,而精神病醫生如何運用以上的原理和信息提高藥物的療效降低毒副作用是至關重要的。對精神病患者用藥回顧分析表明,基因型分析能提高療效,預防ADR,減少這些藥物的治療費用。根據抑鬱症病人表型和基因型分析結果選擇合適的劑量,以此增加療效和預防毒性,進行預期性試驗是必要的。阿片類藥物ADR的顯著差異與CYP2D6的基因多態性有關。右美沙芬,可待因,氫可酮,氧可酮,乙基嗎啡由具多態性的CYP2D6脫羥而代謝。作為一種鎮痛藥時可待因的去甲氧基代謝的多態性具有重要的臨床意義。大約10%可待因經去甲氧基而成為嗎啡,低代謝型缺乏這一途徑,因此可待因對低代謝型並無鎮痛作用。與高代謝型相比,可待因在低代謝型上的呼吸,精神活動和瞳孔作用降低。可待因常被作為慢性嚴重疼痛的首選藥物,醫生必須認識到5-10%的白人為低代謝型,可待因在他們身上將沒有鎮痛效果;同時高代謝者如果正在同時接受CYP2D6強抑制劑(如奎尼丁)的治療,可待因也將沒有鎮痛效果。
CYP2C9另一個藥物代謝基因多態性的重要例子是CYP2C9等位基因突變與華法林所需劑量的關係。臨床回顧性研究發現超過37%的英國人具有一個突變的等位基因,因此他們在用華法林時有較高的出血風險。CYP2C9突變體等基因的純合子攜帶者很罕見(占人口的0.2—1.0%),這種基因型具有更高的華法林不良藥物反應的風險和嚴重的甲苯磺丁脲、格列吡嗪和苯妥英代謝損害。
癌症化療在兒童急性淋巴細胞白血病的治療中,具有嘌呤甲基轉移酶缺陷的病人接受標準劑量的巰基嘌呤、硫鳥嘌呤和硫唑嘌呤時,其嚴重的和潛在致命的骨髓毒性(急性白細胞減少,貧血和凡科尼綜合症)罕見(約為1/300)。這種具有嘌呤甲基轉移缺陷的病人使用巰基嘌呤時需要減少15倍劑量來防止致命的血液系統毒性。此外還有許多類似的情況,5-氟尿嘧啶在二氫嘧啶脫氫酶缺陷病人存在骨髓抑制和神經毒性;葡萄糖醛酸轉移酶(VGT1A1)的啟動子多態性可引起遺傳性葡萄糖醛酸缺陷;抑制拓樸酶的依立替康具骨髓抑制和腹瀉;在N-乙醯轉移酶2快速乙醯化者套用拓樸異構酶Ⅱ抑制劑氨萘非特後出現更嚴重的骨髓抑制。
藥物轉運
藥物的吸收分布與膜轉運系統有關,藥物轉運遺傳學是一個快速發展的領域。多藥耐藥基因MDR1是最近發現的一個例子,它編碼一種ATP依賴的跨膜流出泵(P-糖蛋白),其功能是從細胞內向細胞外轉運包括藥物在內的許多物質,以防止有害物質或代謝物在細胞聚集。MDR1基因的外顯子26(C3435T)的突變與腸道P-糖蛋白的表達水平和功能有關,因此,具這種突變純合子的個體在給予單口服劑量的地高辛後,其血藥濃度要比正常者高4倍,在持續給藥後地高辛的峰濃度也同樣升高。P-糖蛋白的底物包括許多治療濃度很窄的重要藥物,如環孢素A、異博定、特非那定、非索那定和許多HIV-1蛋白酶抑制劑,因此,這種多態性對攜帶這種突變體個體的劑量調節有很大的影響。目前許多學者正關注於其他轉運系統的突變,特別是涉及5-羥色胺、多巴胺和GABA重吸收的轉運系統的突變。
藥物靶點
許多藥物是通過酶(約30%),膜受體(50%)或離子通道(5%)相互作用而發揮效應的。許多編碼這些蛋白的基因具有多態性,因而將改變藥物的反應。研究最多的一個藥物受體是β2-腎上腺素能受體,它的突變體(如通常的16位胺基酸由Arg突變成Gly)是β2支氣管擴張平滑肌反應的主要決定因素。同樣血管緊張素轉換酶(ACE)基因突變被認為是ACE-I反應差異的原因,但是來自不同的研究資料仍有爭議。兩個高親和力磺醯脲(sulphonylurea)受體基因突變的聯合將導致胰島素對甲苯磺丁脲的反應降低40%;5-羥色胺受體HTR2A基因多態性與氯氮平在精神分裂症患者的反應有關;編碼心肌離子通道結構亞單位的五個基因發生突變會影響藥物誘導的長QT間期綜合症的發病風險,長QT間期綜合症的發病率大約是1/10000,是沒有心臟器質疾病的年輕個體心源性猝死的一個潛在原因,所有這五個編碼基因影響鈉或鉀轉運的膜離子通道。
展望
人類基因的全面識別和功能分析正在使疾病研究和藥物開發發生革命,它能使醫生對個體罹患某一特殊疾病的風險作出可靠的估計,提高藥物作用靶點的數目和特異性,解釋藥療和毒性出現個體差異的原因。在對個體ADR危險因素的分析中,研究的最為深入的是單一基因位點上突變的等位基因,其中包括N-乙醯轉移酶基因,硫代嘌呤甲基轉移酶基因,二氫嘧啶脫氫酶基因和細胞色素酶P450基因。基因型分析能預測這些情況的極端表型。然而,以上藥物遺傳學因素如何與其它不同基因以及環境因素(如吸菸,飲食等)共同作用而產生一種表型的,目前對此還知之甚少。個體對藥物的反應在數量和質量上都有很大差異,而這種藥物反應的先天性差異在很大程度上是由其遺傳基因決定的,所以能伴隨一生。整個基因組學為分析這些複雜的多因素情況和獲取個體基因型提供信息和技術,使我們能夠根據病人的基因譜設計與調整劑量,做到最大程度的個體化給藥,從而達到提高療效和可能預防ADR的目的。

