分化
哺乳類動物B細胞的分化過程主要可分為前B細胞、不成熟B細胞、
 胰島B細胞
胰島B細胞成熟B細胞、活化B細胞和漿細胞五個階段。其中前B細胞和不成熟B細胞的分化是抗原非信賴的,其分化過程在骨髓中進行。抗原依賴階段是指成熟B細胞在抗原刺激後活化,並繼續分化為合成和分泌抗體的漿細胞,這個階段的分化主要是在外周免疫器官中進行的。
1.前B細胞(pre-Bcell)前B細胞是從骨髓中淋廠幹細胞分化而來,只存在於骨髓和胎肝等造血組織。前B細胞胞漿中可檢測到IgM的重鏈μ鏈,但無輕鏈,也無膜表面Ig的表達,因此缺乏對抗原的反應能力。末端脫氧核甘酸轉移酶(terminaldeoxynucleotidyltransferaseTdT)以及共同型急性淋巴母細胞白血病抗原(commonacutelymphoblasticleukaemiaantigenCALLA)即CD10可表達在前B細胞,進入非成熟B細胞後這兩種標誌即消失,因此TdT和CD10對於區分前B細胞與B細胞其它發育階段非常有用。CD19、CD20和MHCⅡ類抗原在此階段開始表達。前B細胞對抗原沅應答能力。
2.不成熟B細胞(immatureBcell)開始表達mIgM,但如與抗原結合,則產生負應答,使B細胞轉變為受抑制狀態,不能繼續分化為成熟的B細胞,這是形成自身免疫耐受的機制之一。不成熟B細胞CD19、CD20和MHCⅡ類抗原表達量增加,並可開始表達CD21抗原。
3.成熟B細胞(matrueBcell)骨髓中發育成熟B細胞經血液遷移至外周淋巴器官,此時膜表面同時表達mIgM和mIgD,mIgD的表達防止了B細胞與抗原結合後所引起的免疫耐受。成熟B細胞表達補體受體1(CR1)、致有絲分裂原受體以及多種細胞因子受體。
4.活化B細胞(activatedBcell)成熟B細胞被相應抗原或多克隆刺激劑刺激後成為活化B細胞,斷而發生增殖和分化,在此過程中,膜結合Ig水平逐漸降低,而分泌型Ig逐漸增加,並可發生免疫球蛋白基因重鏈類別的轉換。活化B細胞中的一部分可分化為小淋巴細胞,停止增殖和分化,並可存活數月至數年,當再次與同一抗原接觸時,很快發生活化和分化,產生抗體的潛伏期短,抗體水平高,維持時間長,這種B細胞稱為記憶B細胞(memoryBcell)。
5.漿細胞(plasmacellPC)又稱抗體分泌細胞(antibodysecretingcell)。成熟B細胞接受抗原刺激後,在抗原提呈細胞和Th細胞的輔助下成為活化B細胞,進而分化為漿細胞,合成和分泌各類免疫球蛋白,同時獲得了PC-1(plasmacellantigen-1)等漿細胞特異性標誌,而mIg,MHCⅡ類抗原、CD19、CD20、CD21等標記消失。
病症
糖耐量試驗一般對胰島B細胞瘤診斷幫助不大,
 胰島B細胞
胰島B細胞主要用於鑑別反應性低血糖症。胰島B細胞瘤病人糖耐量曲線可正常低平或呈糖尿病型曲線。
興奮試驗僅用於診斷困難的病例,有的胰島B細胞瘤患者在興奮試驗後可引起長期的與難治性的低血糖,後果十分危險。因此,選擇病例要謹慎,要在嚴密觀察下進行興奮試驗,常用的藥物有甲苯磺丁脲(D)、胰升糖素等。甲苯磺丁脲興奮試驗的做法是:甲苯磺丁脲鈉1克溶於20ml蒸餾水中兩分鐘內靜脈注入,每5分鐘測血糖及血漿胰島素1次,共3次,若其中有1次血漿胰島素水平超過195U/ml,血糖低於22mmol/L(40mg/dl),則提示胰島B細胞瘤,此試驗陽性率約60%。也有報告用口服D或肌注胰升糖素做興奮試驗。
胰島B細胞瘤的定位診斷因80%的腫瘤直徑小於2cm,因此用超聲或CT掃描不易定位,即使是陰性結果亦不能除外。認為選擇動脈造影對胰島B細胞瘤的定位診斷有一定價值。經肝靜脈插管進入脾靜脈採血測血漿胰島素水平,如達300U/ml或以上時,亦可診斷為胰島B細胞瘤。
鑑別診斷 主要與以下兩種疾病鑑別:①反應性低血糖症。是最常見的低血糖症,女性多於男性,30-40歲多見。多發生在餐後2-4小時,高糖飲食易誘發且症狀明顯,數十分鐘後常可自行緩解。若做5小時口服葡萄糖耐量試驗,於第24小時血糖可下降至2.5mmol/L(45mg/dl)左右,並出現低血糖症狀,而後血糖自行恢復正常。如進低碳水化合物、高蛋白飲食,可大大減少反應性低血糖發作。②肝源性低血糖症。重症肝炎、晚期肝硬變與肝癌引起肝組織廣泛破壞產生低血糖。多發生於空腹時,在禁食或延長進食時間後亦可誘發,以神經精神症狀多見,低血糖症狀與肝功能損害程度不一定平行。
治療 一經確診,應手術治療。對因高齡、體弱不適於手術或已有轉移的惡性胰島B細胞瘤患者,除加強支持療法外,可試用藥物治療,如鏈脲黴素可選擇性破壞胰島細胞使血漿胰島素分泌減少,並使50%的腫瘤縮小,一年存活率增加。副作用有胃腸道症狀和腎功能障礙等。氯苯甲噻二嗪可抑制胰島素釋放,刺激兒茶酚胺分泌,使大多數胰島B細胞瘤患者的血糖恢復正常,副作用有鈉瀦留、胃腸道症狀與輕度多毛。
功能恢復
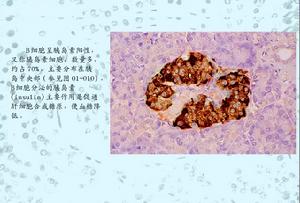
 胰島B細胞檢測
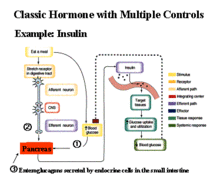
胰島B細胞檢測患上2型糖尿病的原因主要有兩方面:一方面是人體的胰島B細胞功能減退,胰島素分泌相對不足或絕對不足;另一方面是身體對胰島素利用能力減弱,又稱為胰島素抵抗。但不同2型糖尿病患者的胰島B細胞功能狀況和胰島素抵抗程度不同,不同病程的糖尿病患者的胰島素分泌時相和水平也不同。正常人進餐後胰島素呈雙相分泌,而早期2型糖尿病患者一般表現為第一時相胰島素釋放曲線高峰延遲,第二時相分泌增強。2型糖尿病早期是胰島B細胞對葡萄糖的失敏感性階段,此時高血糖暫時抑制胰島B細胞分泌胰島素及外周組織對胰島素的敏感性,使胰島素抵抗加重,B細胞為代償增加的胰島素抵抗需要分泌更多的胰島素,加重胰島B細胞的負荷,加速胰島B細胞功能的衰竭。
新發2型糖尿病患者能否恢復,主要取決於胰島B細胞功能有多大程度的可逆性。1997年,以色列專家在12例新診斷的2型糖尿病患者血糖水平非常高的時候,就用胰島素泵強化治療,結果,其中9例不再服用任何降血糖藥物就可使血糖維持正常9~50個月。平均3年不需用藥,血糖水平控制良好。中國的專家也證明,這種治療能使新發2型糖尿病患者第一時相胰島素釋放恢復正常。從實驗中可以看到,血糖水平很高的初診2型糖尿病患者,在胰島素分泌很少、胰島B細胞功能很差的狀況下,經過一段時間的胰島素強化治療,使血糖控制到正常水平以後,胰島素分泌的幅度可以增加,胰島B細胞功能得到明顯改善。
為什麼新發的2型糖尿病患者在經過胰島素強化治療後,胰島B細胞功能有得到逆轉的可能呢?專家們認為,在高血糖的壓力下,胰島B細胞並沒有死亡,它只是暫時“閉上了眼睛”,雖然高血糖對它有強烈的毒害(如較長期高濃度葡萄糖使B細胞發生不可逆性功能缺陷,醫學上稱為“高葡萄糖毒性”),但是它還頑強地活著,一旦胰島素強化治療驅除了“高葡萄糖毒性”對它所造成的危害,胰島B細胞可以在很大程度上得到恢復。另外,血糖控制良好後,外周組織對胰島素的敏感性有所恢復,消除了高血糖對胰島B細胞的持續刺激,節省了胰島素的分泌,打斷了糖尿病患者的胰島B細胞功能衰竭的惡性循環。
所以,新發的早期2型糖尿病患者的胰島B細胞功能,在相當大程度上是可以恢復的,要儘早消除高血糖對它的毒性,創造一個使胰島B細胞功能恢復的有利條件。當然,我們也看到不同的患者其胰島B細胞功能損害程度也不盡相同,不是所有的2型糖尿病患者胰島B細胞功能都能完全恢復,但至少證明了胰島素強化治療對糖尿病胰島B細胞功能恢復有益。由此可見,胰島素治療在恢復新發2型糖尿病患者的胰島B細胞功能上,起到了非常重要的作用。
作用
胃轉流手術對於胰島B細胞功能恢復的作用
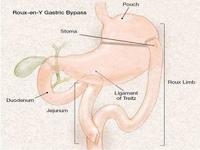
正常情況下食物經過胃、十二指腸、空腸和迴腸,並被消化吸收。胃轉流手術在未切除任何組織或器官的情況下,通過胃部分阻斷、胃腸吻合、腸腸吻合等改變了食物的生理流向。
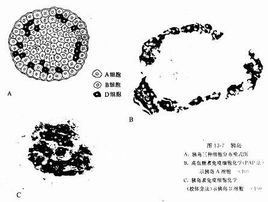
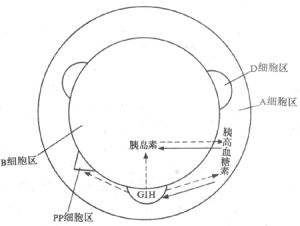
 胰島B細胞
胰島B細胞術後消化道分為兩個區域:
一、食物轉流區:指遠端的胃、十二指腸及部分近段空腸。在這部分消化管腔裡面,有大量的K細胞在黏膜上分布,只要一經過食物刺激,K細胞就分泌大量的細胞因子,這些細胞因子統稱為胰島素抵抗因子,使人體產生胰島素抵抗,這就是糖尿病形成的最初始的原因。如果做了轉流,上消化道不再接受食物刺激,K細胞分泌的胰島素抵抗因子就消失,身體的胰島素抵抗現象就減弱,這樣把糖尿病始發原因去掉了。
二、食物流經區:即近端胃、遠段空腸及迴腸,這段消化道提前接納未消化或未完全消化的食物,導致內分泌調節肽(PYY)、GP1等一些細胞因子的分泌增加。這些細胞因子有以下共同的作用:A:直接降血糖;B:減少胰島細胞凋亡的速率; C:可以通過“腸道--胰島軸”增加了胰島素的敏感性,同時促進胰島素分泌,減少胰島凋亡並使之增殖,刺激胰島細胞增值; D:保護胰島細胞不受糖毒性和其它炎症的危害。這樣導致胰島細胞凋亡的病因也被去掉。
膜表面
B細胞表面有多種膜表面分子,籍以識別抗原、
 胰島B細胞
胰島B細胞與免疫細胞和免疫分子相互作用,也是分離和鑑別B細胞的重要依據。B細胞表面分子主要有白細胞分化抗原、MHC以及多種膜表面受體。
(一)CD抗原
在B細胞表面重要的CD抗原,與B細胞識別、粘附、活化有關的CD分子結構和功能。套用某些B細胞CD抗原相應的單克隆抗體可鑑定和檢測B細胞的數量、比例、不同的分化階段和功能狀態。
(二)主要組織兼容性複合體抗原(MHC)
B細胞不僅表達MHCI類抗原,而且表達較高比便和密度的MHCⅡ類抗原。除了漿細胞外,從前B細胞至活化B細胞均表達MHCⅡ類抗原。B細胞表面的MHCⅡ類抗原在B細胞與T細胞相互協作時起重要作用,此外,還參與B細胞作為輔佐細胞的抗原提呈作用。
(三)膜表面受體
B細胞膜表面具有多種類型的受體。
1.膜表面免疫球蛋白(surfacemembraneimmunoglobulinmIg)這是B細胞特異性識別抗原的受體,也是B細胞重要的特徵性標誌。不成熟B細胞表達mIgM,成熟B細胞又表達了mIgD,即同時表達mIgM和mIgD,有的成熟B細胞表面還mIgG、mIgA或mIgE。在B細胞分化過程中,前B細胞的胞漿中可有IgM的重鏈μ鏈,但無mIgM;當發育為不成熟B細胞時,胞漿中μ鏈消失,胞膜上開始表達mIgM。在單個B細胞表面所有Ig的可變區都由相同的VH和VL基因所編碼,因此它們的獨特型和結合抗原的特異性是相同的。抗原刺激後的B細胞mIgD很快消失,記憶B細胞表面不存在mIgD。作為B細胞受體(bcellreceptorBCR)的mIgM外,還有Igα和Igβ兩種多肽鏈,分別命名為CD79a和CD79b,共同與mIg形成BCR複合物。
2.補體受體(complementreceptorCR)B細胞膜表面具有CR1和CD2。CR1(CD35)可與補體C3b和C4B結合,從而促進B細胞的活化。CD2(CD21)的配體是C3d,C3d與B細胞表面CR2結合亦可調節B細胞的生長和分化。
3.EB病毒受體CR2(CD21)也是EB病毒受體,這與EB病毒選擇性感染B細胞有關。在體外可用EB病毒感染B細胞,可使B細胞永生化(immortlaized)而建成B細胞母細胞樣細胞株,在人單克隆抗體技術和免疫學中有重要套用價值。在體內,EB病毒感染與傳染性單核細胞增多症、BURKITT氏淋巴瘤以及鼻咽癌等的發病有關。
4.致有絲分裂原受體美洲商陸絲分裂原(pokeweedmitogenPWM)對T細胞和B細胞均有致有絲分裂作用。在小鼠,脂多糖(lipopolysaccharideLPS)是常用的致有絲分裂原。此外金黃色葡萄球菌CowanI株(StaphylococcusaureusstrainCowanISAC)因含有金黃色葡萄球菌A蛋白(staphylococcalproteinASPA),可通過與mIg結合刺激人B細胞的增殖。此外,大豆凝集素(soybeanagglutininSBA)可凝集B細胞。
5.細胞因子受體多種細胞因子調節B細胞的活化、增殖和分化是通過與B細胞表面相應的細胞因子受體結合而發揮調節作用的。B細胞的細胞因子受體主要有IL-1R、IL-2R、IL-4R、IL-5R、IL-6R、IL-7R、IL-11R、IL-12R、IL-13R、IL-14R、IL-γR、IL-αR和TGF-βR等。
相關詞條
| 心理應激 | 粘附分子 | 細胞因子 | 補體系統 | 補體 |