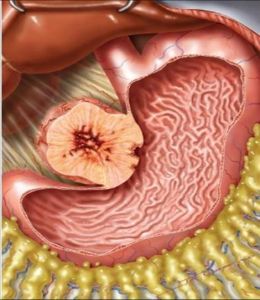
臨床表現
多發群體
胃腸道間質瘤占胃腸道惡性腫瘤的1~3%,估計年發病率約為10-20/100萬,多發於中老年患者,40歲以下患者少見,男女發病率無明顯差異。GIST大部分發生於胃(50~70%)和小腸(20~30%),結直腸約占10~20%,食道占0~6%,腸系膜、網膜及腹腔後罕見。GIST病人20-30%是惡性的,第一次就診時約有11~47%已有轉移,轉移主要在肝和腹腔。
 胃腸間質瘤
胃腸間質瘤疾病症狀
無特異性臨床表現,病程可短至數天長至20年,惡性GIST病程較短,多在數月以內,良性或早期者無症狀。GIST的主要症狀依賴於腫瘤的大小和位置,通常無特異性。胃腸道出血是最常見症狀。賁門部GIST吞咽不適、吞咽困難症狀也很常見。部分病人因潰瘍穿孔就診,可增加腹腔種植和局部復發的風險。常見症狀有腹痛、包塊及消化道出血及胃腸道梗阻等。腹腔播散可出現腹水,惡性GIST可有體重減輕、發熱等症狀。
治療方法
外科手術
:在2001年以前, 在外科手術中完全切除是治癒這種疾病的唯一方法。然而,由於無法精細而且很整齊的把腫瘤的邊緣和轉移部分完全切除,所以在腹部復發的機率相當高。大量的回顧性研究報告復發時間平均是術後19個月,如果腫瘤切除不徹底,病人的生存時間平均只有10——21個月,而一旦復發轉移,治療方案也非常有限,只能進行第二次手術。[1]
放療和化療
:放療很少用於治療胃腸惡性間質細胞瘤,因為臨近的器官對放射敏感,而該腫瘤有高度放射抗拒。儘管化療對胃腸惡性間質細胞瘤的效果也很差,但很多復發轉移的患者仍然接受了多療程的化療,因為沒有更多的治療方案可以選擇。所以患者不得不承受著化療的嚴重副作用。
生物免疫療法
生物免疫療法是繼手術、放療、化療之後治療惡性腫瘤的第四大方法。它是套用生物技術調節和增強腫瘤患者機體的免疫防禦機制以殺傷腫瘤,有效清除病人體內殘存腫瘤細胞的一種新興的腫瘤治療手段。
生物免疫療法中目前套用最廣泛的是多細胞免疫療法,通過採集病體自身免疫細胞,在GMP實驗室中進行體外培養,使其數量成萬倍增多,殺傷功能增強,然後再回輸到人體來殺滅組織中的癌細胞,突變的細胞,具有打破免疫耐受,激活和增強機體的免疫能力的治療效果。該療法有效克服了手術和放化療“不徹底,易轉移,副作用大”的弊端,有效防止了癌細胞的轉移和擴散,提高了機體免疫力,改善生活質量,延長了存活時間,臨床療效在80%以上。
診斷鑑別
1.體檢:部分腫瘤較大的患者可觸及腹部活動腫塊、表面光滑、結節或分葉狀。
2. 實驗室檢查:患者可出現貧血、低蛋白血症,大便潛血陽性。
3. 影像學特點:
3.1 胃鏡及超聲胃鏡檢查:
對於胃GIST,胃鏡可幫助明確腫瘤部位及大小。超聲內鏡對於胃外生性腫瘤可協助診斷,協診GIST位置、大小、起源、局部浸潤狀況、轉移等。部分患者可獲得病理學診斷。
3.2 CT 檢查:
CT 平掃發現腫瘤多呈圓形或類圓形, 少數呈不規則形。良性腫瘤多小於5cm ,密度均勻,邊緣銳利,極少侵犯鄰近器官,可以有鈣化表現。惡性腫瘤多大於6cm,邊界不清,與鄰近器官粘連,可呈分葉狀,密度不均勻,中央極易出現壞死、囊變和出血, 腫瘤可出現高、低密度混雜, 鈣化很少見。增強CT 可見均勻等密度者多呈均勻中度或明顯強化,螺鏇CT 尤以靜脈期顯示明顯。這種強化方式多見於低度惡性胃腸道間質腫瘤,壞死、囊變者常表現腫瘤周邊強化明顯。CT消化道三維重建對於腫瘤可協助診斷,協診GIST位置、大小、局部浸潤狀況、轉移等。
3.3 18FDG-PET和18FDG-PET/CT:
CT,MRI等影像學方法只是評估腫瘤的大小,腫瘤的密度以及腫瘤內的血管分布,不能反應腫瘤的代謝情況,用18氟脫氧葡萄糖的PET檢查可以彌補以上物理學檢查的不足,它的原理是胃腸道間質腫瘤是一種高代謝的腫瘤,利用腫瘤內強烈的糖酵解反應攝取高密度的18氟脫氧葡萄糖跟蹤顯影,對早期轉移或者復發比CT敏感,並且在評估腫瘤對化療藥物的反應時明顯優於其它物理學檢查方法, PET與CT聯合掃描方法能同時評估腫瘤的解剖和代謝情況,對腫瘤的分期以及治療效果的評估優於CT,也為其它實體腫瘤分子靶向治療的療效判斷提供了一個參考。
3.4 其他輔助檢查:
X線鋇餐示邊緣整齊、園形充盈缺損,中央可有“臍樣”潰瘍龕影,或表現為受壓、移位。腸系膜上動脈DSA對於小腸GIST診斷、腫瘤定位具有重要意義。
4. 病理學特點:
在大體標本中,胃腸道間質腫瘤直徑從1-2cm到大於20cm不等,呈局限性生長,大多數腫瘤沒有完整的包膜,偶爾可以看到假包膜,體積大的腫瘤可以伴隨囊性變,壞死和局灶性出血,穿刺後腫瘤破裂,也可以穿透黏膜形成潰瘍。腫瘤多位於胃腸黏膜下層(60%),漿膜下層(30%)和肌壁層(10%)。境界清楚,向腔內生長者多呈息肉樣腫塊常伴發潰瘍形成,向漿膜外生長形成漿膜下腫塊。臨床上消化道出血與觸及腫塊是常見病徵。位於腹腔內的間質瘤,腫塊體積常較大。腫瘤大體形態呈結節狀或分葉狀,切面呈灰白色、紅色,均勻一致,質地硬韌,黏膜面潰瘍形成,可見出血、壞死、粘液變及囊性變。
顯微鏡下特點,70%的胃腸道間質腫瘤呈現梭形細胞,20%為上皮樣細胞,包括梭形/上皮樣細胞混合型和類癌瘤/副神經節型,目前學術界公認非梭形/上皮樣細胞的細胞學形態可基本排除胃腸道間質腫瘤的診斷[2]。 胃腸道間質腫瘤的免疫組織化學的診斷特徵是細胞表面抗原CD117(KIT蛋白)陽性,CD117在胃腸道間質腫瘤的細胞表面和細胞漿內廣泛表達,而在所有非胃腸道間質腫瘤的腫瘤細胞內均不表達,CD117的高靈敏性和特異性使得它一直是胃腸道間質腫瘤的確診指標。CD 34是一種跨膜糖蛋白,存在於內皮細胞和骨髓造血幹細胞上,它在間葉性腫瘤的表達有一定意義,CD 34在60%~70%的胃腸道間質腫瘤中陽性,但由於它可在多種腫瘤中表達,僅對胃腸道間質腫瘤有輕度的特異性,平滑肌肌動蛋白( SMA) 、結蛋白(典型肌肉的中間絲蛋白)及S - 100 (神經標誌物)一般陽性率分別是30% ~40%、1%~2% (僅見於局部細胞)及5% ,均沒有診斷的特異性。
5. 基因突變診斷:
5-7%的胃腸道間質腫瘤中CD117表達是陰性的,此時胃腸道間質腫瘤的診斷要依靠基因突變類型檢測,80%以上的胃腸道間質腫瘤的基因突變類型是KIT或者PDGFRA的突變,這些突變在腫瘤形成的早期就能檢測到,已經發現的KIT的突變類型有4種,外顯子9(10.3%),外顯子11(87.2%),外顯子13(2.1%),外顯子17(0.4%),PDGFR的突變發生在沒有KIT突變的腫瘤中,有三種突變類型外顯子12(3%),外顯子14(<1%),外顯子18(97%),基因突變的檢測可以進一步的明確診斷CD117陰性的患者,診斷家族性胃腸道間質腫瘤,評價小兒胃腸道間質腫瘤,指導化療,預測化療的效果,基因突變的監測在的胃腸道間質腫瘤的診治過程中都是勢在必行。
DOG1(Discovered on GIST-1)是最近發現的一種在GIST中特異表達的一種細胞膜表面蛋白,由DOG1基因編碼,是一種功能尚不明確的蛋白,A.P.Dei Tos等發現在139例胃腸道間質腫瘤腫瘤組織中有136例有表達(敏感度97.8%),並且CD117陰性的胃腸道間質腫瘤中DOG1都有較強的表達,並且在438例非胃腸道間質腫瘤中僅有4例有DOG1的表達,這提示DOG1是一個特異的胃腸道間質腫瘤的診斷標準, 尤其適用於CD117以及KIT和PDGFRA突變基因檢測陰性的胃腸道間質腫瘤的診斷。
GIST 病理診斷流程如圖所示:
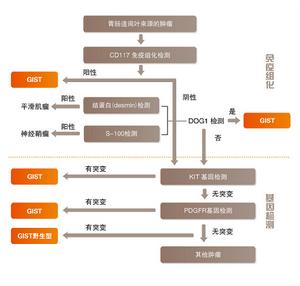 流程
流程疾病治療
手術治療
手術切除:是胃腸道間質腫瘤首選且唯一可能治癒的方法,可行局部切除或行楔形切除,切緣距腫瘤邊緣應超過2cm以上。GIST高危患者術後復發轉移率高,可達55%~90%,80%在術後1~2年內有3/4局部復發,半數還同時出現肝轉移,雖有可能再切除,但難以提高生存率,原發灶切除徹底無轉移灶者5年生存率54%(50%~65%),不能徹底切除或轉移者5年總生存期<35%,不能切除者總生存期 9~12月。
藥物治療
復發/合併轉移胃腸道間質腫瘤的治療
伊馬替尼作為選擇性kit/PDGFRA受體酪氨酸激酶抑制劑,套用於手術不可切除及轉移性病例的治療以及部分高度侵襲危險性病例的術後預防性化療,使GIST的治療發生了革命性的進步。手術切除後復發表現為:原發手術切除部位的新病變,原發病灶以外的部位出現轉移灶,現存腫瘤體積的增大以及在接受伊馬替尼治療的病人病灶中出現結節性高密度影。復發或者轉移的病人的手術預後與腫瘤分期,腫瘤風險評估以及首次手術後無瘤生存的時間有關,DeMatteo等在200例術後復發的病人中研究表明,完整切除復發的轉移灶的病人的中位生存率是54個月,而不完整切除轉移灶或者是有殘餘伴隨病灶的中位生存率下降到5個月。不能手術切除的先行伊馬替尼治療4-12個月,在達到藥物最大療效及早行手術治療,手術後繼續伊馬替尼的藥物治療,手術聯合靶向分子藥物的綜合治療方法明顯的改善了胃腸道間質腫瘤患者的預後。
伊馬替尼耐藥的胃腸道間質腫瘤藥物治療
伊馬替尼的耐藥發生率據統計可高達63%,10-30%的胃腸道間質腫瘤表現出原發性耐藥。原發性耐藥的定義是用藥6個月後腫瘤繼續進展,這種進展往往是多灶性病變,這些耐藥的GIST表達野生型的KIT或者Kit的外顯子9的突變或者是PDGFRAD843V突變。繼髮型耐藥的定義是用藥6個月後再發的耐藥,繼發性耐藥的兩個可能的機制是:首先,突變穩定了KIT激酶的結構阻止了KIT與伊馬替尼的結合,其次,突變干擾了伊馬替尼與KIT結合,繼發耐藥胃腸道間質腫瘤往往表現出外顯子11原發的突變,其次的突變部位是外顯子12,14,17,最近的研究表明原發的外顯子12K643E和外顯子14T670I突變與繼發耐藥有關,而舒尼替尼是一種經口給藥的能夠抑制多種受體酪氨酸激酶活性的有效藥物,舒尼替尼治療靶點包括:VEGFR1-3,CD117,KIT,PDGFRA和PDGFRb,作用譜廣,抑制VEGFR2和PDGFR-A的作用比其它藥物高10-30倍,並且可以抑制對伊馬替尼耐藥的突變類型,目前很多臨床研究結果表明舒尼替尼可以作為伊馬替尼耐藥的一線替代藥物。
噁心程度
表GISTs惡性程度判斷
 噁心胃腸間質瘤
噁心胃腸間質瘤惡性程度腫瘤大小(最大徑,cm)核分裂數/50HPF
低度△
胃≤5≤5
小腸≤2≤2
中度△
胃5~10≤5
小腸2~5≤5
高度△△
胃>10>5
小腸>5>5
註:△腫瘤大小及核分裂數兩項均需符合
△△腫瘤大小及核分裂數有一項符合即可
疾病預後
不同胃腸道間質腫瘤侵襲性確實不同,腫瘤部位、大小、核分裂像、腫瘤術中是否完整切除、組織學類型、免疫組織化學類型、增生抗原表達、增生倍數、性別年齡、突變類型與腫瘤的預後相關,但目前無統一的預後標準。 形態學與預後關係密切的是腫瘤的生物學行為和腫瘤的最大直徑和有絲分裂比率,評估預後時應該綜合以上因素,結合腫瘤發生部位的新分級標準逐漸被臨床醫師採納,腫瘤發生部位成為預測預後的獨立因素,發生於胃的間質瘤比其他部位的間質瘤預後均好,另外基因突變位點的不同與腫瘤的惡性程度相關,雖然不是獨立的預後因素,但KIT外顯子9和外顯子11突變的胃腸道間質腫瘤術後復發率較高,類似的研究也表明瘤細胞核分裂計數和外顯子11的突變均提示高危胃腸道間質腫瘤,預後不良。Miettinen et al發現在胃的間質腫瘤病人中KIT外顯子11的點突變比缺失預後好,KIT外顯子11遠端複製預後好,KIT外顯子9的突變往往預後較差,近些年來基因突變和腫瘤發生部位也越來越被人們重視,已經成為除核分裂計數以外評估預後的重要因素。
綜上所述,基因診斷以及分子生物學的進展使得胃腸道間質腫瘤的診斷取得很大的進展,手術切除仍是胃腸道間質腫瘤治療的首選方法,新型口服抗腫瘤藥物的發明套用顯著的改善了對伊馬替尼耐藥的胃腸道間質腫瘤預後。