背景
 肥胖基因研究
肥胖基因研究肥胖已成為人類面臨的一個嚴重的公共健康問題。中國肥胖者已超過9000萬,超重者高達2億。肥胖不但會導致糖尿病、高血壓、癌症等諸多疾病,還會使人早逝。有數據表明,肥胖者早逝的危險是非肥胖者的1.3-2倍。
許多科學研究表明,基因與肥胖存在千絲萬縷的聯繫。肥胖與遺傳有很大關係,肥胖基因在肥胖的發生中起重要作用。已研究發現的與肥胖相關的基因或染色體區域已達200多個,遺傳對肥胖的影響作用占40%-60%,一半左右的肥胖是由遺傳基因決定的。
研究進展
FTO基因
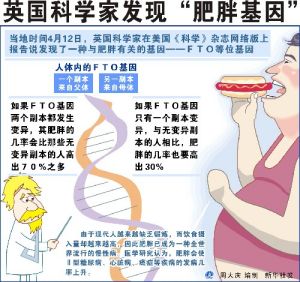
2007年,英國科學家發現與肥胖密切相關的FTO基因,體內FTO基因較多的人平均體重比其他人高3公斤。此次研究中,科學家首次發現FTO基因等“肥胖基因”如何影響一個人的胖瘦。
德國杜塞道夫大學科學家烏爾里希·呂特爾等人的研究也發現,“FTO”基因是一種與肥胖相關的基因,也稱“肥胖基因”。科學研究顯示,FTO基因會抑制新陳代謝,降低能量消耗效率,從而導致肥胖。因此,對於FTO基因及其表達的蛋白質的研究已經成為國際上生物醫學領域的熱點。
FTO的發現源於對2型糖尿病相關基因的搜尋,研究人員對大約39000人進行了採樣分析,斷定攜帶一種FTO變異的兩個副本的人,其體重增加了約3千克,這是關於一種常見肥胖症基因的第一個清晰例證。研究人員在實驗室小鼠體內發現,其大腦下丘腦——用來幫助調節機體的能量平衡——中的FTO含量非常高。與對照組的小鼠相比,下丘腦中FTO減少60%的小鼠往往會拒絕進食。這意味著,FTO在食慾的控制中可能扮演了一個重要角色。
北京生命科學研究所和天津大學科研人員聯手在國際上第一次解析出了FTO基因表達蛋白質的晶體結構,並進一步證明了該蛋白質是一類脫氧核糖核酸(DNA)去甲基化酶(該開創性的研究成果已經在2010年4月8日出版的國際著名學術期刊《自然》雜誌上發表)。
GPR120基因
真正確認發現肥胖基因的是倫敦帝國學院、日本京都大學和法國國立研究所的科研小組,在2012年2月一期的英國《自然》雜誌網路版上,該科研小組宣布全球首次確認到“防止肥胖”的蛋白因子“GPR120”。
研究人員培養出上述基因不發揮作用的小鼠,餵它們吃脂肪比例達到60%的高脂肪食物,如此飼養16周后,將它們與吃同樣高脂肪食物的正常小鼠進行比較。結果顯示,前者體重增加了15%。而對照組的正常小鼠體重增加不到4%。
研究小組還分析了英國、法國等歐洲國家經常進食高脂肪食物的約6900名肥胖者和7650名健康者的“GPR120”基因。結果發現,肥胖者中“GPR120”基因出現變異導致該基因功能下降的比例是2.4%,而健康者當中該基因發生變異的比例約為1.3%。
GPR120基因與飲食肥胖有很大關係,控制GPR120基因即可能控制代謝,有助於遺傳性肥胖體質的診斷,故今後應可針對肥胖、糖尿病等代謝疾病患者,開發預防或治療肥胖的藥品。
ARIA基因
2013年9月,日本一個研究小組近日在英國《自然·通訊》雜誌網路版上報告說,名為“ARIA”的基因與肥胖有關,若抑制該基因表達,即使攝入高脂肪食物,也不容易變胖。京都府立醫科大學等機構的研究人員發現,這種基因具有妨礙脂肪燃燒的功能。當連續14周餵該基因表達被抑制的實驗鼠和正常實驗鼠後發現,前者皮下和內臟脂肪量僅有後者的1/3至1/2。而當“ARIA”基因表達被抑制的實驗鼠食用普通食物時,血糖值並沒有上升,這表明抑制該基因可防止糖尿病的發生。
其他肥胖基因
 肥胖有遺傳基因
肥胖有遺傳基因除了上面所列肥胖基因,科學家還克隆出了5個與人的食慾及體重調節有關的基因,即OB基因, LEPR基因, PC1基因,POMC基因和MC4R基因。
OB基因
人的OB基因定位於第7號染色體長臂(7q31.3),在人類基因組中為單拷貝,全長約20kb,含有3個外顯子,外顯子全長4240bp。OB基因只在脂肪組織中表達,其編碼產物瘦蛋白是一種分泌性蛋白,即瘦素(Leptin),或瘦蛋白,是由167個胺基酸殘基組成的。瘦素在脂肪組織合成後,分泌到血液中,在血液中與其受體LEPRe結合。人的瘦素受體基因LEPR定位於第1號染色體短臂(1p31),其編碼產物瘦蛋白受體屬於類細胞因子受體家族,共有6 種,即Ra 、Rb、Rc、Rd、Re和Rf ,它們是LEPR 基因轉錄後通過不同剪下而生成的。這些受體廣泛分布於腦、心、肝、腎、肺、脾、胰臟、睪丸和脂肪組織中。瘦蛋白與受體LEPRe 結合後生成瘦蛋白2Re;後者將瘦素帶入脈絡膜,在此處瘦素與LEPRa 結合,生成瘦素2Ra;瘦素2Ra將瘦素輸送到腦脊液,在這裡瘦素與廣泛分布在下丘腦的LEPRb 結合,生成瘦素2Rb。LEPRb 是瘦素各種受體中唯一的具有信號傳導作用的跨膜蛋白,它在下丘腦產生的生理效應之一是誘發下丘腦神經細胞POMC 基因表達加強。