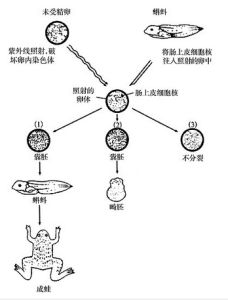
方法介紹
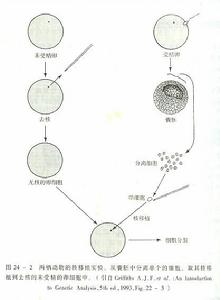
 細胞脫核技術
細胞脫核技術(1)將CB溶於二甲基亞碸中(DMSO),即1mLCB加1mLDMSO作為母液,4℃可存放三年,使用時以1:100加入培養基中,使其最終濃度為10μg/mL。
(2)培養用的塑膠圓板的處理:用無毒的Polystyrene塑膠圓板,厚度需1~1.5mm大小可隨離心管直徑大小而定,只需比離心管口徑略小1~1.5mm,圓板兩側要有兩個凹陷以便用鑷子挾取,為了便於圓板的支撐和平衡離心,在離心管中加入一個圓筒狀的塑膠墊圈,墊圈高2~2.5cm,周邊厚度為2cm,其外徑應與圓板的大小相當,使其與離心管的口徑略小,在離心管中可方便插入和取出,離心前應先把墊圈投入離心管中,把圓板穩固地扣蓋在墊圈上(令其細胞朝下),然後加入CB液略超過圓板,以浸沒細胞。
離心管可用高壓滅菌,塑膠圓板墊圈可用60CO輻照,也可用95%酒精浸過夜,取出用無菌蒸餾水漂洗2~3次,用紫外線對其兩面照射20~30分鐘或更長後,即可使用。
脫核程式
(1)用能貼壁生長的單層細胞,取數個塑膠圓板置入平皿中,接種已製備好的細胞懸液,置37℃%CO2培養。
(2)待細胞形成單層時,在無菌條件下將細胞圓板扣蓋在離心管的墊圈上,令細胞面向下,加入CB(10mg/L)培養基,使其淹沒圓板為宜,為了防止圓板離心時翻轉,在圓板上再放入同直徑的圓柱形垂錘。
(3)有99%細胞的核被脫掉,為防止細胞丟失離心速度不要太高,離心時間不宜太長)。
(4)離心脫核後,沉於管底的為胞核,圓板上的細胞為脫核的胞質體,用PBS漂洗2次,每次1~2分鐘可置入培養液基(不含CB)繼續培養,使細胞恢復原先的正常形態。取出固定染色,也可進行細胞融合及染色質導入試驗,或將胞膜、胞漿分離進行成分分析,或開展膜結構研究。沉於管底的核,因核周圍仍包有薄層胞質和CB,可採用培養液漂洗1~2次,然後用於融合,或將核中染色質導入另一新細胞,或吸出塗片,固定,染色,製成標本。
實驗套用
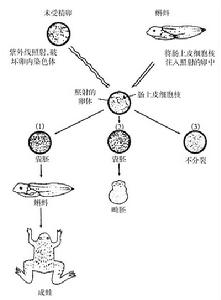
 細胞脫核技術套用
細胞脫核技術套用1材料與方法
取性成熟的ICR小鼠,自由攝食和飲水,每日光照12h。腹腔注射孕馬血清促性腺激素(PMSG,5IU/只,天津天孚高新生物技術公司生產),48h後注射人絨毛促性腺激素(HCG,5Iu/只,上海第一生化藥業公司生產)。HCG注射後13~15h,將鼠撲殺,剪下輸卵管放入HIF—HEPPES(SUt~公司生產)液中,於輸卵管壺腹部處,將輸卵管撕開,卵冠丘複合物逸出。用0.1%的透明質酸酶消化顆粒細胞.3~5min後顆粒細胞鬆散,將卵吸出,在Ⅲ一H液
中反覆洗滌.將卵放人HTF—H—CB液中(CB濃度5btg/m1)。上覆石蠟油,10mln後將操作小室放置於倒置顯微鏡(NiconEclipseTE/300)下進行去核手術。
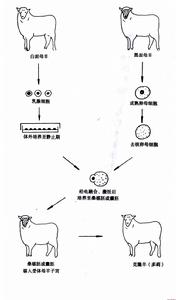
 細胞脫核技術
細胞脫核技術去核後的卵母細胞用0.25%的生理鹽水低滲5rain,然後再用固定液(乙醇:球酷酸=3:1)固定lOmin,空氣中自然乾燥,然後染色,觀寨去核結果。針的製備:拉針儀、鍛針儀均由Narishige公司生產。固定針外徑80~100tan.內徑10tan。去核針外徑10pro,內徑6~8郵。用G一100型,規格lmm×0.9mm肉薄硝子管(Narishige公司生產)在拉針儀(PN一30型NarlshlgeJapan)["用參數(Heat75.1,mainMagic25.1,SubMagi77.1)製備出玻璃針,然後在針的直徑約80tan處,切割玻璃針使其切口平整,再在鍛針儀(MF一900Narish{geJapan)上燒口,使其外徑80~100/~m,內徑10/ma。並使針產生±40。角。拉針儀上用參數(Heat67.7lT~il"iMagic22.1SubMagic77.1)即可製備出外徑1Om,內徑6--8p.m的去核針,然後在鍛針儀上打彎使其產生±40。角。
2結果
小鼠卵因其質膜極易破裂,較難操作,所以採用2步法去核。本組獲卵總數I756個,zPD後存活卵數1731個,存活率98.6%,去核後存活卵數l246個,存活率710%。l246個存活卵中,染色後未見核卵數1070個,去核率85.9%,總去核率61%。
簡要討論
 細胞脫核技術套用
細胞脫核技術套用據文獻報導.最常用的去核方法是活性螢光染料染色定位,去核准確可靠.最高可達99.3%。但有一些作者報導這種操作對重構卵子的發育有影響。小鼠的受體細胞在用Hoechst一33342染色¨去核時,當紫外輻射超過30s,由於卵胞質效應引起發育潛能下降,且其成本、代價均較高,技術要求極為熟練,為筆者所棄。通過對1756枚卵母細胞進行去核手術,體會到核仁粘性較大,且周圍有核膜包裹,呈團塊樣,故只要定位準確,就能將細胞核完整拖出,不帶或只帶出少量胞質。當去核針吸住核時由於核的直徑比玻璃針的口徑大,常粘堵於針口藉助於一定的吸力,即可將核吸出。但核的定位往往較困難,稍許偏差,即會吸人較多的胞質,有時還會使細胞發生崩解。這也是本作者在手術過程中去核後卵存活數(1246枚,存活率為71.0%)不高的原因之一。
當使用盲吸法在手術時如何確定核是否被去淨,可以通過去核後儘快將核從去核針內排出,一方面可防止核堵塞針管另一方面也可通過排出物質性狀來判斷所去除的是否為細胞核。如排出的物質為絲線狀或團塊狀且不易分散,則為細胞核,如排出的物質呈顆粒狀且很快分散,則為細胞質,則可重新定位去核。如在擊核過程中將核破壞,只吸出少量的核,撥針時會見到針口有絲狀物與細胞內連線,這時只需在同一部位再用一定的吸力,即可將核完整吸出,用力過猛,則細胞崩解。撥針後如看到細胞質顆粒一同流出,這個卵可能要溶解。作者將去核後存活的卵數進行固定、染色後觀察核去除的結果,發現有1070枚卵內無核,去核率為85.9%。說明用此法去核有一定的可靠性。但顯微操作是一種技術精度要求極高的操作,從總卵數來看,去核率
僅為61.0%。技術熟練度尚需提高。
針的製備是去核技術的基礎,尤其是去核針的製備:在實驗過程中曾嘗試許多種參數製備許多種管徑的去核針,但都因管徑不符合要求,而使實驗失敗,只有當去核針的管徑外徑/內徑7~10/5~8tan,才使實驗得以繼續。管徑過太,往往吸力不易控制,吸人過多過少的胞質.而使細胞崩解。管徑過小,則吸力過小不足以將核吸出。綜上所述,去核技術是核移植過程中的一個重要步驟,針的製備是其成功的必備條件.細胞核的定位是成功的關鍵。
盲吸去核法
 去核卵母細胞的微衛星位點分析
去核卵母細胞的微衛星位點分析小鼠核移植最早採用盲吸去核法,但因小鼠卵母細胞抗機械損傷能力差,去核後卵母細胞成話率低,目前已被“火奴魯魯法”(Wakayamaetal,1998)取代,該法藉助Piezo系統,去核率高達99%且成活率也達95%,這種方法對那些抗損傷能力差的動物卵母細胞不失為一種有效的替代盲吸法的機械去核法,但該法設備昂貴,不利於推廣…;2005年。白照岱等藉助透明帶膨脹(ZPD)盲吸去小鼠卵細胞核,有效的降低了對卵母細胞的機械刺激,同時減少了操作時間和提高了卵母細胞去核後的成活率,該法對透明帶薄又缺少彈性的卵母細胞較適用,對其它類型卵母細胞是否適用還有待研究。
通常,盲吸法去核的時間選擇在第一極體剛排出時,因隨時間延長卵細胞核遠離第一極體,影響去核效率。嚴興榮等(2005)報導注射hCGlOh後去小鼠卵核,去核率達90%以上;而12h後去核,去核率下降為22%。不同動物的最佳去核時間不同,牛卵母細胞一般為體外成熟18—20h後,而豬卵母細胞則在體外成熟44—48h後為宜。此外,不同動物卵母細胞的結構特點不同,其盲吸法的去核效率也不同。崔奎青等(2005)利用兔卵母細胞透明可在相差顯微鏡下觀察到染色體的特點,將盲吸法與sping-dieview系統結合,去核率達98.4%且損失的胞質少”;而牛和綿羊等動物卵母細胞質中存在大量脂滴。中期染色體在顯微鏡下無法看見,其去核率平均僅為65%(Pratheretal,1987),後來,Tsunoda用Hoechst33342等核特異性螢光染料顯示染色體的位置來引導牛羊等卵子的盲吸去核,
顯著提高了去核效率,但此法需用紫外線照射來顯示卵細胞核,時間(一般15s以內)過長會損害卵細胞,所以現在
一般只用來檢驗去核效果;2001年,王敏康等發現3%的蔗糖溶液能很好的顯示小鼠MⅡ期卵核的位置,顯微鏡
下能100%去核,去除的胞質體積僅為整個卵母細胞體積的1/8—1/12,而且以此去核卵為受體的重構胚發育良好這為牛羊等非透明的卵母細胞盲吸去核提供了新途徑;不過,美國在極性光學顯微鏡的基礎上研製出了一種紡錘體圖像觀察系統(spingdleview),在這種顯微鏡下,可直接觀察到牛等卵母細胞的紡錘體,從而可準確地去核,這種去核方法已逐漸被許多實驗室採用。最後,卵母細胞在清洗和去掉周圍卵丘細胞的過程中,部分卵母細胞的第一極體發生移位,也會影響去核效率(Konoetal,1991),這在小鼠尤為明顯。當然,操作者的熟練程度也是影響盲吸去核效率不容忽視的因素。盲吸去核法雖然存在這樣一些不足,但其操作簡捷、迅速,仍是目前哺乳動物克隆普遍採用的方法。
化學誘導去核法
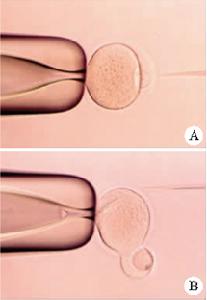
 MⅡ卵母細胞去核前後
MⅡ卵母細胞去核前後許多研究發現,卵母細胞的遺傳背景對去核成功率有很大影響。牛的去核率為91%(Ficsher,2003),豬則較低,為39.4%(Savardetal,2004);Ibanez等(2003)比較了B6D2F1和CF1兩種品系小鼠的去核率(6.9%和21%),兩者存在明顯差異;2003年,Gasparrini對B6CBF1和B6D2F1小鼠進行了類似的研究,雖然它們的
去核率無明顯差別,但在隨後的重構胚發育能力方面表現出明顯的品系依賴性。DC是目前最常用的化學誘導去核劑,其對激活卵母細胞的處理時間是影響去核率的重要因素。Baguisi等的研究發現,小鼠卵母細胞激活後15min,放入含DC培養液中處理,去核率可達54%;而此後的報導卻認為小鼠卵母細胞激活後迅速用DC處理,效果更好。牛卵母細胞在激活30min和12h後分別進行DC處理,去核率從16%提高到91%。因此不同種屬的卵母細胞進行DC處理時,採取的時間間隔有所不同,這很可能與他們的細胞周期進程不同步有關。一般來說,DC處理應在激活卵母細胞由第二次減數分裂後期向末期過渡進行”。此外Dc處理時的長短和卵母細胞的敏感性也是影響去核率不容忽視的因素(Baguisi,2003)。
與盲吸法等建立在顯微作業系統基礎之上的機械去核法相比,化學去核法程式簡單、機械損傷小、胞質丟失少、重複性好、適合大規模卵母細胞去核,具有很樂觀的套用前景。用該法去核的卵母細胞為受體已獲得克隆鼠,而
在其它動物,化學去核只作為輔助手段來製備克隆動物此外將化學去核和無透明帶技術相結合,使核移植可完全
脫離顯微作業系統,目前已發展成為手工克隆(handmadecloning,HMC)。2004年Tecirliogu等採用HMC獲得了體細胞克隆牛,它的成功大大簡化了核移植程式,提高了核移植效率,加快其產業化步伐。
半卵法
 原紅細胞去核後
原紅細胞去核後的基礎上又發展了一種切割去核法,該法將兩枚去透明帶的半卵合二為一,使受體細胞質恢復到去核前的水平,有效的改善了核的重編程和重構胚的發育,同時還簡化了顯微操作技術要求高盼受體卵母細胞去核和注核過程2001年和2003年,丹麥學者Booth和中國學者譚景和成功地將切割去核法套用於牛體細胞核移植和豬體細胞核移植,顯示了該法良好的套用前景。
末期去核法
以往卵母細胞去核均在減數分裂的MⅡ期進行,而Bordignon(1998)卻在牛卵母細胞成熟30h後,用酒精激活,使其排出第二極體,然後去掉第二極體和附近的少量胞質,這就是末期去核法。李裕強(2004)比較了MⅡ期去核和末期去核這兩種去核方法,結果發現末期去核無論是去核率還是胚胎發育率均高於MⅡ期去核(P<0.01)。此外,末期去核還有時間同期化、去除胞質少、有利於重構胚發育、而且選擇的是活化卵子,可篩選掉質量不高的卵子等優點。除上述去核方法外,還有功能性去核法、離心去核法、螢光引導去核法、微分干涉和極性顯微鏡去核法。這些方
法中,有些方法是以上去核方法的有效補充,如螢光引導去核法、微分干涉和極性顯微鏡去核法;有些方法因弊端明顯或操作繁瑣現已很少使用,除非特殊情況,如功能性去核法、離心去核法。