簡介
狀態公理也稱為吉布斯相律,是指對於組元一定的閉口系統,當期處於平衡狀態時,可以用與該系統有關的準靜態功形式的數目n加一個象徵傳熱方式的獨立狀態參數,即(n+1)個獨立狀態參數來確定。它是確立熱力系統平衡態所需的獨立參數數目的經驗規則。
基本公式
(1)平衡態自由度=系統內的組分數–系統相數+2;
(2)獨立參數數目N=不平衡勢差的數目(不平衡勢差彼此獨立)
= 能量轉換方式的數目
= 各種功的方式 + 熱量
= n + 1
n ¾容積變化功、電功、拉伸功、表面張力功等。
(3)簡單可壓縮系統只交換熱量和一種準靜態的容積變化功,簡單可壓縮系統的獨立變數數:N=n+1=2。
吉布斯相律
吉布斯相率是多相體系中的相數、組分數與溫度、壓力、組成等因素相互依存與變化的規律。是熱力學平衡體系普遍遵守的基本規律。
體系內部物理和化學性質完全均勻的部分稱為相。相與相之間在指定條件下有明顯的界面,在界面上巨觀性質的改變是飛躍式的。
體系中相的總數稱為相數,用P表示。
(1)氣體,不論有多少種氣體混合,只有一個氣相。
(2)液體,按其互溶程度可以組成一相、兩相或三相共存。
(3)固體,一般有一種固體便有一個相。兩種固體粉末無論混合得多么均勻,仍是兩個相(固體溶液除外,它是單相)。
(4)固溶體:固態合金中,在一種元素的晶格結構中包含有其它元素的合金相稱為固溶體。在固溶體晶格上各組分的化學質點隨機分布均勻,其物理性質和化學性質符合相均勻性的要求,因而幾個物質間形成的固溶體是一個相。
(5)相平衡體系∶在巨觀上沒有任何物質從一相轉移到另一相的體系。
數學表達式
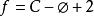 狀態公理
狀態公理相率是相平衡體系中揭示相數φ,獨立組分數C和自由度 f 之間關係的規律,可用上式表示。式中2通常指T,p兩個變數。相率最早由Gibbs提出,所以又稱為Gibbs相率。
單組分系統分析
 狀態公理
狀態公理結論:單組分體系,相數最多為3,自由度最多為2。雙變數體系的相圖可用平面圖表示。
二組分分析
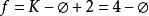 狀態公理
狀態公理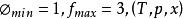 狀態公理
狀態公理——立體圖;保持一個變數為常量,從立體圖上得到平面截面圖
(1)保持溫度不變,得 p-x 圖 較常用
(2)保持壓力不變,得 T-x 圖 常用
(3)保持組成不變,得 T-p 圖 不常用。
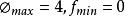 狀態公理
狀態公理,無變數系統,最多四相共存,此時 T、p、x為定值不能改變。
