簡介
製備了Hg(NH)Cl,Hg(NH)NO和Hg(NH)Cl固體.通過實驗對它們在氨水及銨鹽溶液,氨性緩衝溶液,常見酸及配離子共存體系中的溶解性作了定性研究,並從配體平衡,硬軟酸鹼理論和物質結構等方面作了簡要解釋。
實驗及現象
實驗方法
1、氨汞化合物的製備
氯化氨基汞[Hg(NH)Cl]:向8mL 0.1mol·L 的HgCl2溶液中滴加1mL4mol·L 的氨水,將生成的白色澱澱分離,並洗滌至近中性,在70℃下乾燥數小時,得白色固體粉末;
硝酸氨基汞[Hg(NH)NO]:與氯化氨基汞的製備方法類似,得到的產品也是白色固體粉末;
氯化二氨合汞[Hg(NH)Cl]:向8mL乙醚中加入無水的HgCl固體至飽和,再通入用鹼石灰乾燥的氨氣,得白色沉澱;或在8mL飽和NHCl溶液中加HgCl固體至飽和,向其中通入氨氣,得白色沉澱.將白色沉澱分離,分別用相應的溶劑洗滌數次,在60℃溫度下乾燥數小時,均得到白色固體粉末氯化二氨合汞。產品Hg(NH)Cl與Hg(NH)Cl的區別可通過加熱實驗確定。Hg(NH)Cl有固定的熔點,而Hg(NH)Cl加熱時不經熔化就分解。
實驗現象分析
1、氨汞化合物在不同溶劑中的溶解性分析
(1)在氨水中的溶解性
在氨水中,三種氨汞化合物均難溶.這是因為大量氨的存在對該化合物的離解平衡有抑制作用.而且在鹼性條件下,氨汞化合物還轉化成少量淡黃色HgO,使得沉澱的溶解變得更加困難。從HSAB原則看,Hg 是軟酸,而NH是比Cl ,NO 更硬的鹼,取代是難以進行的。
(2)在銨鹽中的溶解性
大量銨根離子的存在對Hg(NH)Cl和Hg(NH)NO的離解是有利的。從離解平衡的角度看,這兩種氨基汞鹽都應該易溶。但事實並非如此.在相同濃度銨根離子的溶液中,Hg(NH)NO易溶,而Hg(NH)Cl不溶。這與Hg(NH)Cl的共價性較強,而Hg(NH)NO的離子性較強有關。
(3)在氨性緩衝溶液中的溶解性
在NHCl/NH·HO的緩衝溶液中,Cl 是大量的。大量Cl 的存在不利於可溶性氨配合物的生成,而有利於沉澱Hg(NH)Cl或Hg(NH)Cl的形成。故Hg(NH)Cl在含大量NHCl的緩衝溶液中是不溶的。由於Hg(NH)Cl的溶解度較Hg(NH)NO小,後者在含大量Cl 的緩衝溶液中轉化為Hg(NH)Cl沉澱。在含少量NHCl的NH·HO中,情況並非如此。雖然Cl 的存在不利於沉澱的溶解,但由於Cl 濃度較小,影響不大。而少量銨根離子的存在有利於Hg(NH) 的離解,大量NH的存在又有利於可溶性配離子Hg(NH) 的形成。因此,兩種氨基汞鹽均易溶於含有少量銨根離子的NH·HO中。
(4)在H+及配體存在時的溶解性
在強酸溶液中,Hg(NH)Cl與Hg(NH)NO均不易受單一H 進攻。
如Hg(NH)Cl,Hg(NH)NO均不溶於HSO,HNO中,即便加熱也不溶,這就是證明。但有較強的配體與H 共存時,情況就不同了。因配體與H 對Hg(NH) 的共同作用,Hg(NH)Cl,Hg(NH)NO均易轉化為可溶性配離子。如兩種氨基汞鹽均易溶於鹽酸。若配體的配位能力較Cl 更強時,無需H 的幫助就能使沉澱溶解。如氨基汞鹽易溶於濃的NaBr,NaI溶液中即是證明。
2、結構分析
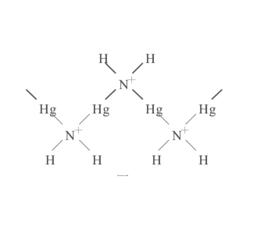
(1)Hg(NH2)Cl
該物質是含有Hg(NH) 單元的鋸齒鏈狀結構,N-Hg-N是直線型。
N原子周圍的兩個H原子和兩個Hg原子形成四面體結構;一個Hg原子周圍除有兩個N原子外,還有四個Cl 配位,構成畸變的八面體結構.鏈和鏈之間是通過共用的配位Cl原子搭橋,處於橋鍵的的配位Cl 不易電離;而N原子價鍵已達飽和,無孤電子對,且顯正電性,H 無法接近帶正電性的N原子。因此,這種結構的氨汞配合物在非配位酸中是相當穩定的。若同時存在H 或銨根離子等對取代出的-NH的共同作用,協助配體對Hg的進攻,這種溶解更易進行。
(2)Hg(NH)NO
這種物質的結構與Hg(NH)Cl是一樣的,只是由於NO 與CI 在結構及配位能力上的差異使得它們在溶解性上略有差異。
結論
由試驗結果及以上分析,可以得出以下三點結論:①在氨水中,三種氨汞化合物均難溶;②在非配位酸中,僅Hg(NH)Cl在加熱下緩慢溶解。而在配位酸中(如HX),三種氨汞化合物均可溶;③大量Cl 的存在不利於可溶性氨汞配合物的形成,而有利於Hg(NH)Cl和Hg(NH)NO沉澱的形成;銨根離子的存在或有比Cl 更強的配體存在,有利於可溶性氨汞配合物的形成。