化學性質
 氟銻磺酸
氟銻磺酸 氟銻磺酸酸性極強,以至於高氯酸在其中都會被質子化:
HClO₄+HSbF5(OSO₂F)====[SbF5(OSO2F)]-+[H2ClO4]+
在這種酸性環境下,一般情況下很多無法進行的有機化合反應可以順利進行。故氟銻磺酸常作為現代化工合成反應的催化劑。
超強酸能向鏈烷烴供給質子,使其質子化形成碳正離子。
R3CH+[H2SO3F]+<---->[R3CH2]++HSO3F<---->H2+[R3C]++HSO3F
超強酸對鏈狀鹵素和硫陽離子的研究提供了一個優良的溶劑介質。
氟銻磺酸還是一種良好的溶劑和腐蝕劑,可以將包括金、鉑在內的極不活潑金屬氧化溶解。氟銻磺酸通常儲存在聚四氟乙烯的容器內。在室溫下氟銻磺酸和玻璃作用劇烈,並能溶解烴類有機物,可以將有機含氧化合物脫水炭化,但和含鉛塑膠玻璃(一種狀似玻璃的透明有機含鉛有機材料,主要成分是全氟聚苯乙烯、聚四氟乙烯、和二氟化鉛,如圖所示)反應很慢,故一般用含鉛塑膠玻璃製成的細口瓶盛裝。
氟銻磺酸酸使某些很難質子化的物質(如高氯酸)質子化,進一步製備含有-ClO3基團的有機物:
HClO4+H+====[H2ClO4]+
[H2ClO4]++H+====[ClO3]++[H3O]+
C6H6+[ClO3]+====[C6H6ClO3]+
[C6H6ClO3]+-H+====C6H5ClO3
氟銻磺酸酸使高級烷烴質子化,催化烷烴裂解:
(CH3)3CH+H→(CH3)3C+H2;
(CH3)4C+H→(CH3)3C+CH4
氟銻磺酸酸含有羥基的有機物(如醇、酚、羧酸等)質子化,進一步脫羥基化。
R-OH+2H=R+(碳正離子)+[H3O]+
強氧化劑:Sb(V)氟化物例如SbF5具有一定的氧化性,加上它超強的酸性,大大增加了氧化能力,能夠氧化腐蝕多種金屬。要注意的是,氟銻磺酸是無水體系,當氟銻磺酸與大量水混合時發生強烈反應,失去超酸性。
物理性質
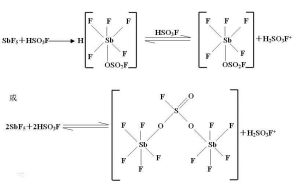
氟銻磺酸是無色透明的粘稠液體,含雜質時為淡黃色、棕色甚至是黑綠色。有明顯的刺激性氣味,純淨的氟銻磺酸密度大致為3.61-3.82g/ml,無固定熔沸點。化學性質
氟銻磺酸是超強酸之一,可以看作五氟化銻和氟硫酸的混合物,SbF5與FSO3-離子結合成[SbF5(OSO2F)]-離子,使電離出的氫離子幾乎不受粒子引力控制。[SbF5(OSO2F)]-在水溶液中完全電離,暴露在空氣中強烈吸水並有部分水解形成Hsbo3、HF、H2SO4和其他強酸及一些絡合物。故久置的魔酸中還有少量SbO3-、F-、SO42-、SbO+、SbO2+離子。SbF5(OSO2F)]-離子有和氟離子一樣的活性。當皮膚沾到氟銻磺酸時先會被脫水炭化,接著碳被溶解,[SbF5(OSO2F)]-離子及少量SbO3-、F-等離子進入血液,使鈣、鎂離子失活,導致人體中毒。
氟銻磺酸酸性極強,以至於高氯酸、在其中都會被質子化:
HClO4+HSbF5(OSO2F)====[SbF5(OSO2F)]-+[H2ClO4]+
在這種酸性環境下,一般情況下很多無法進行的有機化合反應可以順利進行。故氟銻磺酸常作為現代化工合成反應的催化劑。
超強酸能向鏈烷烴供給質子,使其質子化形成碳正離子。
R3CH+[H2SO3F]+<---->[R3CH2]++HSO3F<---->H2+[R3C]++HSO3F
超強酸對鏈狀鹵素和硫陽離子的研究提供了一個優良的溶劑介質。
氟銻磺酸還是一種良好的溶劑和腐蝕劑,可以將包括金、鉑在內的極不活潑金屬氧化溶解。氟銻磺酸通常儲存在聚四氟乙烯的容器內。在室溫下氟銻磺酸和玻璃作用劇烈,並能溶解烴類有機物,可以將有機含氧化合物脫水炭化,但和含鉛塑膠玻璃(一種狀似玻璃的透明有機含鉛有機材料,主要成分是全氟聚苯乙烯、聚四氟乙烯、和二氟化鉛,如圖所示)反應很慢,故一般用含鉛塑膠玻璃製成的細口瓶盛裝。
氟銻磺酸酸使某些很難質子化的物質(如高氯酸)質子化,進一步製備含有-ClO3基團的有機物:
HClO4+H+====[H2ClO4]+[H2ClO4]++H+====[ClO3]++[H3O]+C6H6+[ClO3]+====[C6H6ClO3]+
[C6H6ClO3]+-H+====C6H5ClO3
 氟銻磺酸
氟銻磺酸氟銻磺酸酸使高級烷烴質子化,催化烷烴裂解:
(CH3)3CH+H→(CH3)3C+H2;
(CH3)4C+H→(CH3)3C+CH4
氟銻磺酸酸含有羥基的有機物(如醇、酚、羧酸等)質子化,進一步脫羥基化。
R-OH+2H=R+(碳正離子)+[H3O]+
強氧化劑:Sb(V)氟化物例如SbF5具有一定的氧化性,加上它超強的酸性,大大增加了氧化能力,能夠氧化腐蝕多種金屬。要注意的是,氟銻磺酸是無水體系,當氟銻磺酸與大量水混合時發生強烈反應,失去超酸性。
發現過程
1966年聖誕節,美國Case Western Keserve大學,G.A.Olah教授實驗室一位研究人員J.Lukas無意中將聖誕節晚會上用過的蠟燭扔進一個酸性溶液(SbF5·HSO3F)中,結果發現蠟燭很快地溶解了,促使他進一步研究,此實驗溶液去做核磁共振研究(14C-NMR),令人驚奇的是核磁共振譜圖上竟出現了一個尖銳的特丁基陽離子(碳正離子)峰。這種酸能溶解飽和烴。從那時起,Olah實驗室人員就給SbF5·HSO3F起個綽號叫“魔酸”(Magicacid)。現在人們習慣地將酸強度超過100%H2SO4的一個酸或酸性介質叫做超酸(或超強酸),把SbF5·HSO3F稱作魔酸。也就是後來所說的超強酸。超強酸不但能溶解蠟燭,而且能使烷烴、烯烴等發生一系列化學變化,這是普通酸難以做到的。例如,正丁烷在超強酸的作用下,可以發生C—H鍵的斷裂,生成氫氣;發生C—C鍵的斷裂,生成甲烷;還可以發生異構化反應生成異丁烷。在奧萊教授和他的學生這一發現的啟示下,迄今為止,科學家們已經找到多種液態和固態的超強酸。液態的有HF·SbF5、TaF5·HSO3F等。固態的有SbF6·SO2ZrO、SbF5·SiO2·Al2O3等,它們都有類似於SbF5·HSO3F的性質。
套用價值
目前,超強酸在化學和化學工業上,極有套用價值,它既是無機及有機的質子化試劑,又是活性極高的催化劑。過去很多在普通環境下極難實現或根本無法實現的化學反應在超強酸環境中。卻能異常順利地完成。而由於超強酸的酸性和腐蝕性強的出奇,所以過去一些極難或根本無法實現的化學反應,在超強酸的條件下便能順利進行。比如正丁烷,在超強酸的作用下,可以發生碳氫鍵的斷裂,生成氫氣,也可以發生碳碳鍵的斷裂,生成甲烷,還可以發生異構化生成異丁烷,這些都是普通酸做不到的。
可以預料,隨著這些具有超常酸性和腐蝕性超強酸的相繼問世,化學和化學工業將會迅速走進新時代。
比較
以下的資料是以哈米特酸度函式作為依據(哈米特酸度函式(H0)是一種用於衡量高濃度酸酸性的指標,包括超強酸。它是由物理有機化學家路易斯·普拉克·哈米特(LouisPlackHammett)建議使用的,這也是最著名的酸度函式,它對於超出pH值範圍的情況是很有用的。H0每減小一個單位,即表示酸性增強10倍。),哈米特酸度函式以大負數H0值表示:
氟銻酸(1:1)(1990)(H0=−28)
魔酸(五氟化銻合氟磺酸(1:1),簡稱氟銻磺酸)(1974)H0=-25)
碳硼烷酸(1969)(H0=−18.0)
氟磺酸(1944)(H0=−15.1)
三氟甲磺酸(1940)(H0=−14.6)
純高氯酸(H0=-13.0)
純硫酸(H0=-11.93)
氯化氫(H0=−8.0)
貯存方法
密閉,氮氣下保存,-20°C
超強酸
魔酸(五氟化銻合氟代磺酸,簡稱氟銻磺酸)的酸性是公認的最強的,值得注意的是魔酸是混合物,由HSO3F與SbF5的混合配置而成的,另外含氧酸的確切定義是由O、H與一中心原子組成的可自主電離出質子的物質,其酸性最強的配置比為HSO₃F:SbF5=2:98(摩爾比)這才是真正人們所說的魔酸。如果你學了配位化學就會明白魔酸酸性強的原因了。
其酸性強的機理:首先HSO₃F(氟磺酸,或單氟硫酸)的酸性本身比HClO₄強,不過在水溶液中由於拉平效應它們的水溶液酸性強度是一樣的(就像濃度一樣的硝酸溶液和鹽酸溶液酸性一樣,我們一般認為HNO3與HCl的酸性是不可區分的,但事實上不是),在HSO3F電離出H+後由於O、F強拉電子作用(誘導效應)使負電荷電荷較均勻的分布於整個離子,減弱了質子對陰離子團的庫侖力使質子能更好的電離出去。
然後是SbF5的作用,(SO3F)-中由於存在S→O的配位鍵使O上帶較明顯的負電SbF5中由於F對Sb的誘導效應,使Sb帶較強的正電性且Sb上存在一個5p空軌道(為強Lewis酸)正好可以與(SO3F)-中的O上的孤電子對形成較強的配位鍵就是說存在S→O→Sb,這樣負電荷就擴散到了更大區域,並且受到了SbF5基團對負電荷的很好禁止,最多(SO3F)-可以與3個SbF5配合,不過配合度越低越穩定,因為SbF5基團太大互相牴觸,(SO3F)-不能更好與太多的SbF5很好配合,因而可以解釋魔酸中SbF5的量相當大,這樣H+對該配合物基本不存在庫侖力了所以H+變得相當自由甚至可以“趴在”電子云密度相對較大的C-H鍵上形成二電子三中心鍵很不穩定易分解生成碳正離子與H2。