病因
(1)環境因素:接觸電離輻射有利於白血病的發生。二次世界大戰時日本發生核子彈爆炸後。當地白血病發病率增高即證實這一點。接觸治療性輻射也增加白血病的發病率。長期接觸苯等有毒化學物品與急性非淋巴細胞白血病有關。其他與ALL發病可能有關的化學物品有除草劑。殺蟲劑。孕婦酗酒。避孕藥。菸草及化學溶劑。但這些因素與ALL發病的確切關係尚不肯定。(2)感染因素:孕婦宮內胎兒感染可增加5歲以下兒童患ALL的危險。感染導致ALL危險性增加的機制可能是感染導致基因組的不穩定性增加。資料證明EB病毒感染可能與L3型ALL相關。也有ALL發病與HIV感染相關的病例報告。A型肝炎病毒感染與兒童ALL高發病率有關。改善公共衛生狀況可降低母親孕期感染及新生兒感染。對降低ALL的危險性將起到不可忽視的作用。母乳餵養可降低嬰兒感染性疾病的發生。餵養方式與兒童急性白血病(AL)的相關性報導不一。目前的觀點傾向於母乳餵養可降低兒童白血病發生的危險。與感染相關的其他因素包括免疫接種。動物接觸史。藥物套用史(如氯黴素)。季節變化等。它們與兒童白血病的確切相關性尚無定論。
(3)免疫缺陷:先天性免疫缺陷者淋巴系統惡性腫瘤的發病率增高。
(4)先天性基因(遺傳)因素:早期文獻報導對確診時年齡2個月和14歲的同卵雙胞胎通過分子生物學方法研究證明。來自宮內同一胎兒。同一細胞擴增或突變後的同卵雙生的同胞ALL的發生是一致的。由於這種疾病在雙胞胎沒有臨床的和生物學上的差異。有人猜測某些獨生子的白血病可能起源於胎內。並且進一步推測附加因素或出生後環境因素導致在出生後的任何時間發生白血病。為驗證這一假設。研究者用新生兒血印記檢測現有的克隆或與患者相關的特殊白血病相關融合基因序列(TEL-AML1)。發現t(12;21)與TEL的非易位等位基因的缺失之間的相關性在B系ALL最常見。這些研究提示兒童急性淋巴細胞白血病為胎內起源。有報告白血病患兒(包括ALL)同胞的白血病發病率比普通人群高2~4倍。單卵雙胎中一個發生白血病後。另一個發生白血病的機會高達25%;發病年齡越小。另一個發病的機會越高;當發病年齡>7歲時。另一個發病的機會明顯減少。說明白血病的發生可以有先天性遺傳因素參與。但確切的基因因素尚未十分明了。
分型
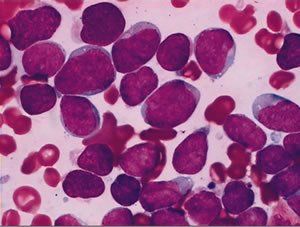
根據形態學。免疫學和遺傳學分型(即MIC分型)。可分為幾個亞型。治療及預後與分型密切相關。(1)形態學分型:目前國際通用FAB分型。即按照細胞大小。核漿比例。核仁大小及數目。胞漿嗜鹼程度。將急淋分為L1~L3三型(表1)。小兒ALL以L1型最多見。占70%左右。L2型為25%左右。L3型僅占0%~4%。
(2)免疫學分型:白血病發生學的成熟遏制學說認為。白血病是造血細胞的某一克隆被阻滯在某一分化階段上並異常增殖的結果。因此白血病細胞具有相應的正常細胞分化階段的免疫標誌。國際上用“分化簇”(CD:clusterofdifferentiation)對單克隆抗體(MCAB)統一命名。目前將ALL主要分為T細胞系和B細胞系兩大類。兒童ALL以B細胞係為主。占80%左右。B細胞系ALL又可分為若干亞類。目前尚無統一標準。各家不一。有的分為4型(表2)。有的分為6型。T細胞學ALL一般分為3型(表3)。由於白血病細胞具有“異質性”和“非同步性”。其免疫表型的表達差異非常大。少數病人可以同時或先後表達兩種或兩種以上系列的特徵。稱為混合性白血病(mixedlineageleukemia。MAL)或雜合性白血病(hybridleukemia。HAL)。這類白血病可能起源於多能幹細胞。一般分為3型:①雙表型:指同一個白血病細胞同時表達淋系和髓系特徵。②雙系型(雙克隆型):指同時存在具有淋系和髓系特徵的兩群獨立細胞群。③轉換型:指白血病細胞由一個系列向另一個系列轉化。
(3)細胞遺傳學分型:由於細胞遺傳學的發展。特別是高分辨分帶技術以及分子探針的套用。使白血病的分型又向前推進一步。目前發現90%以上的ALL具有克隆性染色體異常。染色體異常包括數量異常和結構異常。ALL多數表現為46條染色體。其中以假二倍體為主。其次為超二倍體。①數量異常:A.超二倍體:約占ALL的1/4。以前B-ALL多見。雖然二倍體可累及任何一條染色體。但以4。6。10。14。17。18。20。21及X染色體最常見。B.假二倍體:即伴有結構異常的46條染色體。常表現為染色體易位。以L2型多見。C.亞二倍體:較少見。約占3%~8%。以45條者居多。一般為20號染色體缺失。②結構異常:兒童ALL中。已發現近40種非隨機的染色體結構異常。其中約50%為染色體易位。多數已明確其基因定位。對於兒童白血病而言。比較重要和常見的有:A.t(1;19)(q23;p13):多見於兒童pre-BALL。位於19p13的E2A基因是一種看家基因。屬於HOX基因家族。E2A/PBXI融合基因的pre-BALL預後和治療效果較差。B.t(12;21)(p13;q22):這是近些年才被發現的一種較為常見的染色體易位。位於12p13的TEL基因具有螺鏇-迴轉-螺鏇結構。同樣編碼一種轉錄因子。具有這種易位的ALL預後較好。原因不清。C.t(8;21)(q22;q22)易位:主要見於AML-M2。位於8q22的ETO基因含有2個鋅指結構。可能編碼一種轉錄因子。但目前認為AML1/ETO融合基因的形成並非白血病發病的關鍵因素。必須有其他遺傳學改變才能造成發病。D.t(9;22)(q34;q11):見於95%的CML和3%~5%的兒童ALL。這是最為經典的白血病染色體易位。其結果是產生了BCR/ABL(break-pointclusterregiongene。Abelsononcogene)融合基因。這被認為是細胞惡變的根本原因。另外。BCR/ABL融合基因還被認為是檢測微小殘留病(MRD)的重要標誌。E.t(15;17)(q24;q21):見於AML-M3。形成PML/RARα融合基因。具有這種易位的AML-M3對全反式維A酸治療較敏感。同時。PML/RARα也被認為是檢測MRD的重要標誌。F.inv(16)(p13;q22):見於AML-M4Eo。染色體倒位的結果產生了CBFβ/MYHl1(平滑肌肌球蛋白重鏈基因)融合基因。G.涉及MLL基因的染色體畸變:MLL基因位於11q23。又稱為ALL1。HRX。Hrtx1基因。具有轉錄因子和DNA甲基轉移酶的許多特性。涉及它的染色體畸變包括t(1;11)。t(4;11)。t(6;11)。t(9;11)。t(10;11)。t(11;17)。t(x;11)等。多見於嬰兒白血病。包括ALL。AML和MDS等。因此被稱為mixedlineageleukemiagene。患兒預後多較差。由於白血病涉及的染色體易位如此眾多。如何快速簡便地檢出這些畸變便成為臨床亟待解決的問題。北京兒童醫院目前已建立並開始採用多重PCR方法檢測新診斷白血病患兒的染色體易位情況。這種方法採用8個平行PCR反應。同時檢測29種白血病相關的染色體結構畸變/易位(包括87種mRNA剪接變異株)。目前已檢出的畸變有t(1;19)。t(7;10)。t(8;21)。t(9;22)。t(12;21)。t(15;17)。TAL1D。dup(11q23)等8種染色體畸變(13種剪接變異株)。
(4)MIC分型:1985年4月在比利時組成了MIC協作組。將形態學。免疫學和細胞遺傳學結合起來。制定了MIC分型(表4。5)。(5)臨床分型:臨床一般將ALL分為標危(standardrisk。SR)和高危(highrisk。HR)兩大類。1998年6月山東蓉城中華醫學會兒科血液學組“小兒急淋白細胞診療建議”分型如下:①與小兒ALL預後確切相關的危險因素:A.<12個月的嬰兒白血病。B.診斷時已發生中樞神經系統白血病(CNSL)和(或)睪丸白血病(TL)者。C.染色體核型為t(4;11)或t(9;22)異常。D.小於45條染色體的低二倍體。E.診斷時外周血白細胞計數>50×109/L。F.潑尼松誘導試驗60mg/(m2·d)×7天。第8天。外周血白血病細胞≥1×109/L(1000/μl)。定為潑尼松不良效應者。G.標危ALL誘導化療6周不能獲完全緩解(CR)者。②根據上述危險因素。臨床分型分為2型:A.高危ALL(HR-ALL):具備上述任何一項或多項危險因素者。B.標危ALL(SR-ALL):不具備上述任何一項危險因素者。伴有或不伴有t(12;21)染色體核型和≥50條染色體的高二倍體B系ALL。
表現及診斷
各類型小兒急性白血病臨床表現相似。其主要臨床表現歸結為貧血。出血。發熱和白血病細胞對全身各臟器。組織浸潤引起的症狀。除T-ALL起病較急外。一般起病相對緩慢。通常表現為進行性蒼白。乏力。食慾減退。盜汗。虛弱。低熱和出血傾向。亦有最初表現為上呼吸道感染的症狀。或出現皮疹。然後出現無力等症狀。從起病到診斷可長達數月。也可以驟然起病。以不規則發熱。急速的進行性蒼白。明顯的出血症狀和骨關節疼痛等症為首發表現。起病數天至數周即得以診斷。但多數病人在起病後2~6周內明確診斷。1.貧血常早期出現。輕重不等。表現為進行性蒼白。以皮膚和口唇黏膜較明顯。可出現活動後氣促。心悸。顏面水腫。虛弱無力等症狀。T-ALL由於發病較急。確診時貧血反而不嚴重。貧血和出血程度常不成比例。
2.出血極大部分患兒均有不同程度的皮膚和黏膜出血。表現為皮膚紫癜。烏青和瘀斑。甚至發生皮下血腫。齒齦出血。鼻出血。口腔黏膜滲血。嚴重者可出現眼底視網膜出血。導致視力減退。顱內壓增高。消化道和泌尿道出血。臨床表現為便血。嘔血和尿血。顱內出血時表現為頭痛。嘔吐。抽搐和昏迷等。出血原因除血小板的質與量異常外。亦可由於白血病細胞對血管壁的浸潤性損害。使滲透性增加。T-ALL偶可發生DIC。可能由於原始T-ALL細胞釋放凝血酶。激酶等物質所致。
3.發熱與感染半數以上患兒有發熱。熱型不定。發熱的原因主要是繼發感染。多數患兒起病時有不同程度發熱。可為低熱。不規則發熱。持續高熱或弛張熱。暫時性熱退時常大汗淋漓。發熱的原因包括腫瘤性發熱和感染性發熱。前者用抗生素治療無效。而用吲哚美辛(消炎痛)0.5mg/kg體重。每8小時口服。熱可退淨。以此鑑別腫瘤性發熱和感染性發熱。常見的感染部位有呼吸系統。敗血症。齒齦。口腔潰瘍。皮膚癤腫。腸道炎症。肛周炎也頗為常見。常見的病原菌為大腸埃希桿菌。銅綠假單胞菌。副大腸桿菌等革蘭陰性桿菌。金黃色葡萄球菌和表皮葡萄球菌等革蘭陽性球菌。其他還有糞鏈球菌。克雷白桿菌。陰溝桿菌。硝酸鹽陰性桿菌。黏質沙雷菌。弗枸櫞酸桿菌等條件致病菌和厭氧菌。此外可有巨細胞包涵體病毒(CMV)。皰疹病毒。EB病毒感染。真菌感染也較常見。有白色念珠菌引起鵝口瘡。肛周真菌症。真菌性腸炎和深部真菌感染。上述各種感染可單獨發生也可混合感染。臨床常表現為不規則或弛張性發熱。
4.白血病細胞在臟器浸潤表現
(1)網狀內皮系統浸潤:ALL易有網狀內皮系統的浸潤。約2/3患兒有脾臟輕或中度腫大。肝臟多輕度腫大。質軟。淋巴結腫大多較輕。局限於頸。頜下。腋下。腹股溝等處。有腹腔淋巴結浸潤者常訴腹痛。
(2)骨關節浸潤:約有1/4的患兒以骨或關節痛為起病的主要症狀。這是由於白血病細胞浸潤骨膜或骨膜下出血所致。表現為持續性並陣發性加劇的骨。關節疼痛或腫痛。行動受礙。多見於膝。脛骨。胸骨。踝。肩。腕。肘關節處。易被誤診為風濕關節炎或骨髓炎。
(3)中樞神經系統浸潤:顱內壓增高症狀可出現在病程的任何時期。尤其在套用化療而未採取有效的中樞神經系統白血病預防者。T-ALL在發病早期即出現中樞神經系統浸潤。表現為顱內壓增高。有頭痛。嘔吐。視盤水腫所致視力模糊。也可引起面癱等腦神經損害症。甚至發生癲癇樣發作。意識障礙等。
(4)腮腺浸潤:表現為兩側腮腺無痛性增大。質地較硬。無壓痛或輕度壓痛。
(5)睪丸浸潤:睪丸浸潤時有單側或雙側睪丸無痛性腫大。質地堅硬。壓痛不明顯。透光試驗呈陰性。隨著病程的延長。若不採用有效預防措施。睪丸白血病的發生將增多。合併睪丸白血病的平均病程為13個月。大多在骨髓處於完全緩解時發生。若不及時治療。則可導致骨髓復發。
(6)腎浸潤:ALL時腎浸潤並不少見。可因水腫。尿量尿色改變而就診。有時腎臟明顯腫大可在兩側腹部觸及。腹部B型超聲或CT可見腎臟有多發性浸潤灶。
(7)其他:如皮膚。胃腸道。肺。胸膜和心臟浸潤時。引起相應臟器功能障礙的症狀。合併縱隔淋巴結腫大或胸腺浸潤。可產生呼吸困難。咳嗽等症狀。臨床上出現典型的症狀。體徵。外周血中查見白血病細胞。骨髓中原始加幼稚細胞≥30%。此時診斷急性白血病並不困難。若是發病初期。症狀。體徵不典型。外周血不見原幼細胞。此時診斷有一定難度。
1.感染性發熱對不明原因的貧血。出血。發熱和不能以感染完全解釋的發熱。以及多臟器浸潤症狀表現者應考慮本病診斷。
2.貧血。肝。脾。淋巴結腫大對體格檢查中發現有與出血程度不相符的貧血。肝。脾。淋巴結腫大者。尤其有腮腺。睪丸和軟組織浸潤腫大者。以及伴有骨。關節痛明顯者應考慮本病的診斷。
3.實驗室檢查外周血發現≥2個系列異常或見有幼稚細胞者應考慮到本病的可能。進一步做骨髓塗片檢查。骨髓檢查對於診斷十分重要。但應注意白血病細胞在體內分布不均勻現象。必要時行多部位穿刺方能確診。
預防
1.避免接觸有害因素避免接觸有害化學物質。電離輻射等引起白血病的因素。接觸毒物或放射性物質時。應加強各種防護措施;避免環境污染。尤其是室內環境污染;注意合理用藥。慎用細胞毒藥物等。2.大力開展防治各種感染性疾病。尤其是病毒感染性疾病。做好預防接種。
3.做好優生工作。防止某些先天性疾病。如21-三體。范可尼貧血等。加強體育鍛鍊。注意飲食衛生。保持心情舒暢。勞逸結合。增強機體抵抗力。