簡介
 反相氣體色譜
反相氣體色譜氣相色譜法的一種。與經典的氣相色譜相反,在反相氣體色譜中,把要研究的聚合物作為固定相(通常將聚合物均勻地塗布在惰性載體表面,或將聚合物製成薄膜狀、纖維狀或粉狀裝填在色譜柱內),用已知的揮發性化合物作為探針分子隨著載氣輸入到色譜柱,通過合適的檢定器測定探針分子流過色譜柱的保留時間;再把保留時間換算成單位重量聚合物的保留體積,稱為比保留體積Vg。根據所得的Vg值,可以推算出聚合物與探針分子之間的熱力學相互作用參數;或通過Vg隨溫度的變化和Vg隨載氣流速的變化等,反映聚合物的某些物理性質。
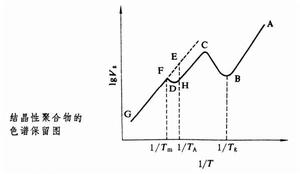
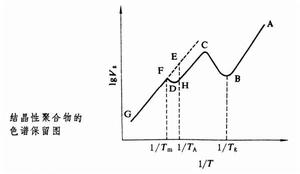
在氣相色譜中,不論是吸附在固定相還是溶解在固定相的氣體,其比保留體積總是隨著柱溫T的升高而減小;且lgVg與1/T呈線性關係。而對於固定相是聚合物的反相氣體色譜,當色譜柱溫處在聚合物的玻璃化溫度Tg以下時,探針分子經過色譜柱時只能被吸附在聚合物表面,當柱溫升高到Tg以上時,聚合物的自由體積增大,探針分子可以溶解並擴散到聚合物內部。所以隨著溫度的升高,在lgVg對1/T的圖(見圖)中,首先是從A到B線性下降,然後在由玻璃態向高彈態轉變時,Vg增大,BC向上彎曲,因而可以確定聚合物的Tg。
 反相氣體色譜
反相氣體色譜
熔化後的聚合物在熔融溫度以下某一指定溫度保持恆溫,Vg隨時間增加而下降,這可反映結晶生長的過程,因此利用Vg隨時間的變化可研究聚合物的結晶動力學。
對於結構相同而分子量不同的低聚物,可以利用同一種探針分子來分別測定它們的Vg值,只要知道其中一種低聚物的分子量,就可算出其他低聚物的分子量。由於探針分子同聚合物的溶解度和保留值是相互對應的,還可利用這一原理挑選合適的分級溶劑。
探針分子經過色譜柱後,lgVg峰有加寬現象。這是由於探針分子在氣相和固定相間擴散所致,因此可從峰形的寬度算出探針分子在聚合物固定相中的擴散係數。
利用保留體積隨時間的變化來研究各種聚合反應或高分子反應也很方便,而且需要的試樣少,不需要採樣分析。例如在研究粘合劑的固化反應時,可以在接近實際的實驗條件下進行。
由於反相氣體色譜方法簡便,不論是用於動力學測量還是熱力學測量,都具有它的優越性。
反相器
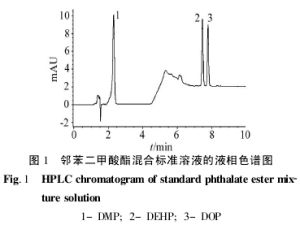 反相色譜
反相色譜反相器是可以將輸入信號的相位反轉180度,這種電路套用在摸擬電路,比如說音頻放大,時鐘振盪器等。在電子線路設計中,經常要用到反相器 。
電路組成及工作原理
典型TTL與非門電路電路組成輸入級——電晶體T1和電阻Rb1構成。中間級——電晶體T2和電阻Rc2、Re2構成。輸出級——電晶體T3、T4、D和電阻Rc4構成,推拉式結構,在正常工作時,T4和T3總是一個截止,另一個飽和。
反相色譜
 反相色譜
反相色譜根據流動相和固定相相對極性不同,液相色譜分為正相色譜和反相色譜。流動相極性大於固定相極性的情況,稱為反相色譜。非極性鍵合相色譜可作反相色譜。在現代液相色譜中套用最廣泛,現代液相色譜分析工作的70%以上是在非極性鍵合固定相上進行的。
反相液相色譜柱效高、分離能力強、保留機理清楚,是液相色譜分離模式中使用最為廣泛的一種,對於生物大分子、蛋白質及酶的分離分析,反相液相色譜正受到越來越多的關.反相色譜法是以表面非極性載體為固定相,面以比固定相極性強的溶劑為流動相的—種液相色譜分離模式.反相色譜固定相大多是矽膠表面鍵合疏水基團,基於樣品中的不同組分和疏水基團之間疏水作用的不同而分離.在生物大分子分離中,多採用離子強度較低的酸件水溶液,添加一定量乙腈、異內醇或甲醇等與水互溶的有機溶劑作流動相.普通的反相色譜固定相和孔徑大於300Å的矽膠鍵合烷基固定相套用較為普遍,聚合物基質的反相色譜固定相也有較多套用.
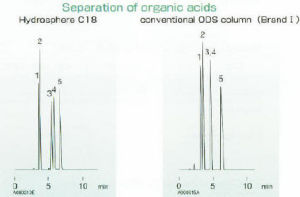 反相色譜
反相色譜反相色譜中樣品的保留值主要由固定相比表面積、鍵合相種類和濃度決定,保留值通常隨鏈長增長或鍵合相的疏水性增強而增大,對於非極性化合物通常遵循以下規則:(弱)非鍵合矽膠<<氰基<C1(TMS)<C3<C4<苯基<C8≈C18(強).溶質保留值與固定相表面積成正比,普通載體(80Å)的表面積約為250m/g,而300Å孔徑載體的比表面積約為60m/g。當其他條件相同時,溶質在300Å孔徑(低表面積)色譜柱上的保留值大約為80Å孔徑色譜柱上保留值的1/4(60:250),小孔隙柱如高保留的C18柱或石墨碳柱有利於強親水性樣品洗脫.樣品的保留值也可以通過改變流動相組成或溶劑強度來調整,溶劑強度取決於有機溶劑的性質和其在流動相中的濃度.在反相色譜中,採用高溶劑強度、低極性的流動相時可獲得較低保留值.固定相的不同也可以導致選擇性發生變化,氰基、苯基、C8、C18等柱的選擇性有很大差異,一般應優先考慮C8、C18柱,然後是氰基柱,再次是苯基柱.
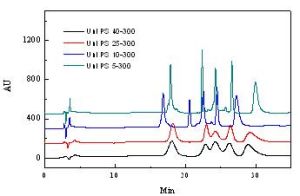 反相色譜
反相色譜反相條件下,大多數蛋白質由於低PH、有機溶劑存在、溫度高於室溫和疏水鍵合相等綜合原因發生變性,這些化合物可能以兩種或兩種以上獨立或動態平衡的形式存在,它們通過色譜柱的保留速度不同,導致譜峰展寬、變形、甚至出現單一蛋白有多個峰的現象,部分變性也易使蛋白在柱上聚集,造成被洗脫蛋白的回收率低和鬼峰.反相色譜固定相表面烷基鏈長度對蛋白質的反相保留和蛋白質的活性回收有很大差異,烷基鏈越長(C8、C22、C30),固定相疏水性越強,為使蛋白質等生物分子洗脫,流動相合機溶劑的含量較高,疏水性過強,會導致生物分子的不可逆吸附和生物活性損失,因此短鏈烷基固定相(C4、C8、苯基等)在生物大分子分離中表現出優勢。對多數小蛋白,在低pH乙腈/水梯度下,用C3~C8色譜柱分離,使蛋白完全展開並避免聚集或沉澱,能夠得到理想的分離結果。
在低pH流動相條件下進行分離,如(0.1%TFA適合於大多數樣品,10~25mmol/L磷酸對疏水性強的蛋白質更有利;以乙腈作有機溶劑,丙醇可能對疏水性強的蛋白質有利;柱溫50~80℃;將樣品溶於6mol/L尿素或鹽酸胍中(只可在室溫)進行預處理;用疏水性更強的鍵合相(長鏈與短鏈烷基鍵合相);加兩性表面活件劑分離大分子和疏水性強的蛋白質等實驗條件有利於蛋白質樣品完全變性或儘可能降低變性。