分子勢能
 分子勢能
分子勢能歸類
是內能的重要組成部分
所以分子勢能與分子間的相互作用力的大小和相對位置有關。
分子之間存在引力和斥力,但分子間距大於平衡位置的間距r0 10倍以上的時候,他們之間的作用力就變得十分微弱,可以忽略不計,而碎玻璃之間的距離對於分子來說是巨大的,所以他們之間可認為沒有作用力。
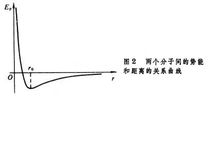
分子勢能與分子距離的關係
1.分子距離在平衡距離處分子勢能最小
2.分子距離在大於平衡距離和小於平衡距離時其分子勢能將增大
3.分子距離在小於平衡距離時,斥力大於引力,分子勢能表現為斥力,最大值在零距離處.
4.分子距離在大於平衡距離時,引力大於斥力,分子勢能表現為引力,無窮遠處為0.
5.分子距離在無窮遠處引力和斥力都為零,引力引起的勢能最大.
6.分子距離在無窮近處引力和斥力最大,斥力引起的勢能最大
補充:分子熱運動的分子間勢能取決於物體的體積。
分子勢能與內能
內能
內能(internal energy)是物體或若干物體構成的系統(簡稱系統)內部一切微觀粒子的一切運動形式所具有的能量總和(動能和勢能)。內能常用符號U表示,內能具有能量的量綱,國際單位是焦耳(J)。
分子動能
物體內部大量分子做無規則運動所具有的能量叫分子動能。
物質的溫度是它的分子熱運動的平均動能的標誌。
理想氣體
中文名稱:理想氣體
英文名稱:ideal gas
定義1:一種具有以下特點的氣體:(1)服從蓋-呂薩克定律,因而滿足理想氣體的狀態方程。(2)內能僅是溫度的函式。(3)比熱容與溫度無關。
套用學科:大氣科學(一級學科);動力氣象學(二級學科)
定義2:嚴格遵守理想氣體狀態方程 pV=nRT 的假想氣體。
套用學科:電力(一級學科);通論(二級學科)
