正文
而在液相中,溶劑的存在妨礙分子直接碰撞,A和B之間須經過擴散(見擴散控制)進行接觸,達到偶遇,形成偶遇對,也稱擴散對,其量用偶遇對濃度來表征。在標準狀況下,氮氣分子的體積只占所占有空間的 0.2%,在液相中雖達50%以上,但若有溶劑,則大大降低其反應速率。圖
 是用計算機計算的液體中分子在瞬時位置的一張模擬剖面“快相”。它顯示出液相中分子近似於一種無規則緊密堆積,某一區間內含有不穩定的微晶,其中分子的相對取向卻相當規整。在此溶液中,反應物分子處於溶劑分子“籠”的包圍之中(見籠效應),分子A和B通過擴散可以偶遇。相A和B恰好是構成一個反應(如A+B─→P)所必需的反應物分子時,在一個籠中的反覆碰撞稱為一次偶遇,它暗示A和B陷於一個溶劑籠中,形成的偶遇對(也稱擴散對)用【A—B】表示,都被溶劑分子所包圍。它具有反應物的組成和近似產物的結構。因此,在相同的濃度和分子大小情況下,由於液相中分子偶遇的數目比氣相中分子的碰撞數少,而偶遇對在同一籠中相互碰撞數增多,對於有些反應(如五氧化二氮的分解)而言,氣相和液相中的反應速率就不相上下。
是用計算機計算的液體中分子在瞬時位置的一張模擬剖面“快相”。它顯示出液相中分子近似於一種無規則緊密堆積,某一區間內含有不穩定的微晶,其中分子的相對取向卻相當規整。在此溶液中,反應物分子處於溶劑分子“籠”的包圍之中(見籠效應),分子A和B通過擴散可以偶遇。相A和B恰好是構成一個反應(如A+B─→P)所必需的反應物分子時,在一個籠中的反覆碰撞稱為一次偶遇,它暗示A和B陷於一個溶劑籠中,形成的偶遇對(也稱擴散對)用【A—B】表示,都被溶劑分子所包圍。它具有反應物的組成和近似產物的結構。因此,在相同的濃度和分子大小情況下,由於液相中分子偶遇的數目比氣相中分子的碰撞數少,而偶遇對在同一籠中相互碰撞數增多,對於有些反應(如五氧化二氮的分解)而言,氣相和液相中的反應速率就不相上下。 偶遇對的觀點認為,液相反應要經過以下步驟:
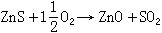
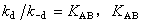 為擴散平衡常數,它與溶液中偶遇數、液體的結構和其他性質有關;kr是偶遇對發生化學反應的反應速率常數。
為擴散平衡常數,它與溶液中偶遇數、液體的結構和其他性質有關;kr是偶遇對發生化學反應的反應速率常數。
