概述
修美樂(阿達木單抗) 是全球研究型生物製藥機構艾伯維的旗艦產品處方藥,且獲得國家食品藥品監督管理總局(CFDA)批准用於強直性脊柱炎和類風濕關節炎。修美樂在全球範圍內已擁有長達16年的臨床試驗經驗,它是艾伯維研發的全球首個被批准的腫瘤壞死因子(TNF)-α全人源單克隆抗體藥(生物製劑)。目前,全球88個國家和地區已有超過67萬名患者正在接受修美樂治療。
修美樂在中國獲批用於2個適應證分別為類風濕關節炎、強直性脊柱炎 。大量數據證明,修美樂在療效、安全性和患者體驗等方面表現相當出色,很大程度地改善了患者疾病症狀。
成分
活性成分:阿達木單抗,在中國倉鼠卵巢細胞中表達的重組全人源化腫瘤壞死因子α單克隆抗體。
分子量:148,108±8Da
輔料:甘露醇、檸檬酸一水合物、檸檬酸鈉、磷酸二氫鈉二水合物、磷酸氫二鈉二水合物、氯化鈉、聚山梨酯80、氫氧化鈉、注射用水
本品為預填充於注射器中的澄明液體。
適應證
修美樂(阿達木單抗)在全國範圍內已擁有2個適應證,分別為類風濕關節炎、強直性脊柱炎。
類風濕關節炎(RA)是一種以對稱性、多關節、小關節為主的慢性自身免疫性疾病,素有“不死癌症”之稱,患病者的免疫系統會破壞健康關節,引發關節疼痛、腫脹、僵硬,產生疲勞和無力的症狀,晚期可強直和畸形、功能嚴重受損,並最終導致關節功能喪失。
修美樂與甲氨蝶呤合用,用於治療:對改善病情抗風濕藥(DMARDs),包括甲氨蝶呤療效不佳的成年中重度活動性類風濕關節炎患者。修美樂與甲氨蝶呤聯合用藥,可以減緩患者關節損傷的進展(X線顯示),並且可以改善身體機能。與傳統的藥物相比,這類藥物的療效強效持久,能有效緩解疾病症狀、延緩放射學進展及改善功能水平,且安全性良好,適用於各種類風濕關節炎患者。
強直性脊柱炎(AS)是以骶髂關節和脊柱附著點炎症為主要症狀的疾病。與HLA-B27呈強關聯。某些微生物(如克雷白桿菌)與易感者自身組織具有共同抗原,可引發異常免疫應答。強直性脊柱炎是四肢大關節,以及椎間盤纖維環及其附近結締組織纖維化和骨化,以及關節強直為病變特點的慢性炎性疾病。
修美樂用於常規治療效果不佳的成年重度活動性強直性脊柱炎患者。有起效快(幾小時到24小時),療效好的特點。大多數患者的病情可迅速獲得顯著改善,如晨僵、腰背痛、外周關節炎、肌腱末端炎、擴胸度、ESR和CRP等,套用一段時間後,患者的身體功能及健康相關生活質量明顯提高,特別是可使一些新近出現的脊柱活動功能障礙得到恢復。
用法用量
本品的治療應在具有類風濕關節炎、強直性脊柱炎診斷和治療經驗的專科醫生的指導監控下進行。
對於那些治療醫師認為適當,並能在必要時進行醫療隨訪的患者,在接受了正確注射技術培訓後,可以自行注射給藥。
成人
類風濕關節炎
對於患有類風濕關節炎的成人患者,建議用量為 40mg 阿達木單抗,每兩周皮下注射單劑量給藥。本品治療的過程中,應繼續使用甲氨蝶呤。
在本品的療程中,可以繼續使用糖皮質激素、水楊酸類藥物、非甾體類抗炎藥或者鎮痛藥。有關與甲氨蝶呤以外的其它改善病情抗風濕藥(DMARDs)聯合使用的情況,請參見【注意事項】和【藥理毒理】部分。
在單一藥物治療時,如某些患者出現治療效果下降,可以將用藥劑量增加為每周注射40mg 阿達木單抗以改善療效。
中斷給藥
如果在手術前或發生嚴重的感染,可能需要中斷給藥。
已有數據表明間隔 70 天或更長時間後再次使用本品,都會達到與中斷給藥之前相同程度的臨床應答與類似的安全性。
強直性脊柱炎
對於患有強直性脊柱炎的成人患者,建議用量為 40mg 阿達木單抗,每兩周皮下注射單劑量給藥。
對於所有上述的適應證,已有數據表明通常在治療 12 周內可獲得臨床應答,對在該治療期間內未出現臨床應答的患者,應謹慎考慮是否繼續治療。
老年患者
無需進行劑量調整。
肝和/或腎功能不良患者
未在此類患者人群中進行本品研究,尚無劑量建議。
不良反應
 修美樂
修美樂臨床研究
對 7552 名患者進行了最多長達 60 個月的關鍵對照和開放研究。這些患者包括:短期和長期患有類風濕關節炎的患者、幼年特發性關節炎、銀屑病關節炎、強直性脊柱炎、克羅恩病、潰瘍性結腸炎和銀屑病的患者。表 1 中的數據來自於關鍵對照研究的對照期或自發報告,其中包含了接受本品治療的 5029 名患者,以及在對照階段接受安慰劑或活性對照藥物治療的 3035名患者。
在關鍵研究的雙盲對照階段,本品治療組和對照組中由於不良事件而中斷治療患者的比例為 5.8%和 5.9%。
安全性總結
最常報告的不良反應是感染(比如鼻咽炎、上呼吸道感染和鼻竇炎)、注射部位反應(紅斑、瘙癢、出血、疼痛或腫脹)、頭痛和骨骼肌肉疼痛。
已有本品嚴重不良反應的報告。包括本品在內的 TNF-拮抗劑會影響人體免疫系統,使用此類藥物可能影響人體對於感染和癌症的防禦功能。也有一些病例報告了使用本品引起的致死感染和威脅生命的感染(包括膿毒症、機會感染和結核)、B型肝炎復發以及多種惡性腫瘤(包括白血病、淋巴瘤和肝脾 T細胞淋巴瘤)。
也有嚴重血液系統反應、神經系統反應和自身免疫性反應的報告,這些反應包括各類血細胞減少症、再生障礙性貧血、中樞和外周脫髓鞘不良事件,還包括狼瘡、狼瘡相關症狀和史蒂芬強森綜合徵(Stevens-Johnson syndrome)等報告。
在表 1 中,按照人體器官分類和發生率(非常常見≥1/10;常見≥1/100 至<1/10;少見≥1/1000 至<1/100,罕見≥1/10000 至<1/1000,不詳:無法根據現有數據估計)列出了在臨床研究和上市後的不良反應。
在以下按照頻率劃分的各組中,不良反應根據嚴重度呈降序排列。本表中已包括在各個適應證中觀察到的最高頻率的不良反應。SOC欄中星號(*)表示更多相關信息參見【禁忌】、【注意事項】和【不良反應】。
注射部位反應
在關鍵性對照臨床試驗研究中,接受本品治療的患者中有 14%出現了注射部位反應(紅腫和/或瘙癢,出血,疼痛或腫脹),而接受安慰劑或活性對照藥物的患者,上述反應占 8%。一般而言,無需因為注射部位反應中止用藥。
感染
在關鍵性對照臨床研究中,接受本品治療的患者感染率為 1.50/患者-年,而接受安慰劑和活性對照藥物治療的患者為 1.42/患者-年。感染主要是鼻咽部炎症、上呼吸道感染,以及鼻竇炎。絕大多數患者在痊癒後繼續本品治療。
在接受本品治療的患者中,嚴重感染的發生率為 0.03/患者-年,在使用安慰劑和活性對照藥物的患者中,該比率為 0.03/患者-年。
在對照和開放的研究中,報告了嚴重感染的病例(包括致命性感染,但極少發生),這些報告包括結核(包括粟粒狀和肺外結核)以及侵襲性機會感染(例如播散性或肺外組織胞漿菌病、芽生菌病、球孢子菌病、肺孢子蟲病、念珠菌病、麴黴病和李斯特菌病)。絕大多數的結核發生在治療後的前八個月中,可以反映出潛伏疾病的復發特徵。
惡性疾病和異常淋巴細胞增生
在本品的關鍵性對照研究階段,對患有中重度活動期類風濕關節炎、銀屑病關節炎、強直性脊柱炎、克羅恩病、潰瘍性結腸炎和銀屑病的患者進行至少為期 12 周的研究。在接受本品治療的 4527 名患者中,惡性病變(除淋巴瘤和非黑色素皮膚癌)的發病率為6.1/1000 患者-年[2.7,10.0(95%置信區間)];相比之下,2730 名對照患者(本品中位治療時間為 5.4 個月,對照中位治療時間為 4.0 個月)的發病率為 5.2/1000 患者-年[2.5,11.0(95%置信區間)]。在本品治療的患者中,非黑色素皮膚癌的發病率為 9.5/1000 患者-年[6.4,14.1(95%置信區間)],對照患者為 3.7/1000 患者-年[1.6,9.0(95%置信區間)]。在上述皮膚癌中,本品治療患者鱗狀細胞癌的發病率為 3.0/1000 患者-年[1.5,6.1(95%置信區間)],而對照組的相應數據為 0.7/1000 患者-年[0.1, 5.3]。本品治療患者淋巴瘤的發病率為 0.8/1000 患者-年[0.2,3.0(95%置信區間)],對照組的相應數據為 1.5/1000 患者-年[0.4,6.0(95%置信區間)]。
將研究的對照部分與正在進行的和完成的開放的擴展研究相結合,後者的中位觀察時間約為 3.2 年,包括了 5331 名患者共超過 21800 患者-年的治療,所觀察到的除淋巴瘤和非黑色素皮膚癌以外的惡性病變發病率為 8.2/1000 患者-年。而非黑色素皮膚癌的發病率大約為 10.2/1000 患者-年,淋巴瘤大約為 1.3/1000患者-年。
自 2003年 1月至 2009年 12 月上市後的經驗表明(主要為類風濕關節炎患者),報告的惡性腫瘤發病率約為 2.6/1000 患者-年。而所報告的非黑色素皮膚癌和淋巴瘤的發病率大約分別為 0.2/1000 患者-年和 0.3/1000患者-年(見【注意事項】)。
上市後,罕有關於肝脾 T細胞淋巴瘤的不良反應的報告(見【注意事項】)。
自身抗體
在類風濕關節炎研究 I~V 中,對患者進行多個時間點的血清採樣,檢測自身抗體。在這些研究中,基線期抗核抗體陰性的患者,在 24 周后表現為滴定陽性,在接受本品治療和接受安慰劑與活性對照治療患者的比例分別為 11.9%和 8.1%。在所有接受本品治療的類風濕關節炎和銀屑病關節炎的 3441 名患者中,有 2 名患者出現了支持狼瘡樣綜合徵診斷的臨床表現。在停止治療後,患者症狀得到改善。無患者發展為狼瘡性腎炎或出現中樞神經症狀。
肝酶升高
類風濕關節炎臨床研究:在對照性類風濕關節炎臨床研究(RA 研究 I~IV)中,丙氨酸氨基轉移酶(ALT)升高在接受阿達木單抗與安慰劑治療的患者相同。對於早期的類風濕關節炎患者(患病時間小於 3 年)(RA研究 V),單獨使用甲氨蝶呤或單獨使用本品相比較,在聯合用藥(本品/甲氨蝶呤)的情況下,ALT 的升高更為常見。在幼年特發性關節炎試驗中,僅有少數患者的轉氨酶輕微升高,安慰劑和阿達木單抗的患者的升高結果類似,轉氨酶的升高大都發生在與甲氨蝶呤聯用時。
銀屑病關節炎臨床試驗:與類風濕關節炎患者的臨床研究相比,銀屑病關節炎患者的ALT 升高更常見(銀屑病關節炎研究 I~II)。
在所有的類風濕關節炎、幼年特發性關節炎和銀屑病關節炎研究中,ALT 升高的患者沒有症狀,絕大多數病例的升高為一過性,可以在隨後治療中緩解。
銀屑病臨床試驗:在對照性銀屑病臨床試驗中,接受阿達木單抗或安慰劑治療的患者中 ALT 的升高類似。
克羅恩病和潰瘍性結腸炎臨床研究:在對照性臨床研究中,接受阿達木單抗或安慰劑治療的患者中 ALT 的升高類似。
禁忌
對於本品或製劑中其它成分過敏者。
活動性結核或者其它嚴重的感染疾患,諸如敗血症和機會感染等(參見【注意事項】部分)。
中度到重度心力衰竭患者(NYHA分類 III/IV 級)(參見【注意事項】部分)。
注意事項
感染
使用 TNF拮抗劑的患者更易發生嚴重感染。肺功能受損可能增加感染髮生的風險。
在使用本品之前、期間及使用後,必須嚴密監測患者是否出現感染,包括結核。由於阿達木單抗的清除可能長達 4個月,因此在此期間應持續進行監測。
無論是慢性活動性或局灶活動性感染,在感染未得到控制之前均不能開始本品治療。在有結核暴露史的患者和在結核或地方性真菌病(如,組織胞漿菌病、球孢子菌病或芽生菌病)高風險的地區旅行的患者中開始接受本品治療之前,應對治療的風險和效益進行評估(參見機會感染)。
治療過程中出現感染的患者應予以嚴密監測並對其進行全面的診斷評估。當患者出現新的嚴重感染或膿毒症時,應中斷本品治療,採用適當的抗菌藥或抗真菌藥治療,直到感染得到控制。對具有感染復發病史、或者具有易於感染的情況,包括使用免疫抑制劑的患者,醫生在考慮對這些患者使用本品治療時應當慎重。
嚴重感染:
臨床研究數據表明接受本品治療使患者增加了嚴重感染的風險,包括由細菌、分枝桿菌、侵襲性真菌、寄生蟲和病毒引起的膿毒症或其他機會性感染,如李斯特氏菌和肺孢子菌。
在臨床試驗中發現了其他嚴重感染,包括肺炎、腎盂腎炎、化膿性關節炎和敗血症。也出現過由感染引發的住院或致死事件的報告。
結核:
在接受本品治療的患者中出現了有關結核的報告,值得注意的是,在絕大多數報告中,所出現的結核均屬於肺外型,即播散性。
在進行本品治療前,必須對所有患者進行活動性和非活動性(潛伏性)結核感染的評估。在該評估中,應該包括患者本人的詳細結核病史,以及以往與活動性結核患者的接觸史,和/或當前所採用的免疫抑制劑治療。必須對所有患者進行適當的篩查檢驗,即結核菌素皮試以及 X 線胸片檢查(應該符合當地的防治指南)。並且建議在患者病史中記錄檢驗結果。處方醫生應該考慮到結核菌素皮試假陰性的可能性,尤其是那些患有嚴重疾病或正在使用免疫抑制劑的患者。
如果確診患者具有活動性結核,禁止使用本品治療(參見【禁忌】部分)。
如果懷疑為潛伏性結核感染,必須向具有結核治療經驗的醫師進行諮詢。在下述的條件下,醫生必須仔細權衡治療所帶來的利益與存在的風險。
如果確診為非活動性(潛伏性)結核,在使用本品藥物進行治療前,必須根據當地治療措施對潛伏性結核進行適當的結核預防治療。
對於那些具有數個或顯著結核風險因素,但潛伏性結核篩查為陰性的患者,在進行本品藥物治療前,應該考慮給予抗結核治療。
對於那些具有潛伏性和活動性結核感染病史,卻又不能確定進行過足夠療程治療的患者,在進行本品治療前,應該考慮給予適當的抗結核治療。因為在進行本品治療期間,某些曾經接受過治療的潛伏性和活動性結核患者,重新轉為活動性結核。
如果在本品治療過程中或治療後,患者出現了結核感染的體徵/症狀(例如,持續性咳嗽、消耗性體質/體重減輕、低熱)應該建議患者立即就診。
其它機會感染:
在接受本品治療的患者中觀察到包括侵襲性真菌感染在內的機會感染。由於此類感染在以往使用 TNF-拮抗劑的患者中未被認知而延誤了適當治療,可能會導致致命的後果。
對於出現發燒、不適、體重下降、發汗、咳嗽、呼吸困難和/或肺浸潤或其他嚴重的全身性疾病(有或無伴隨休克)等徵兆或症狀的患者,應被疑似為侵襲性真菌感染,並立即停止使用本品。應與具有侵襲性真菌感染診治經驗的醫師協商,對這些患者進行診斷並實施抗真菌治療。
B型肝炎再激活
接受腫瘤壞死因子(TNF)拮抗劑(包括本品)治療慢性B型肝炎病毒攜帶者(即表面抗原陽性),曾經報導過出現B型肝炎的再激活。一些病例已出現危及患者生命的結果。在接受本品治療之前,患者應進行 HBV 感染檢測。對於B肝病毒檢測結果為陽性的患者,建議諮詢有治療B肝經驗的相關專業醫生。
對於那些需要進行本品治療的B型肝炎病毒攜帶者,應該在整個治療過程以及治療後幾個月中嚴密監控B型肝炎病毒感染的體徵和症狀。目前,尚無B型肝炎病毒攜帶者接受抗病毒和 TNF 拮抗劑聯合治療防止B型肝炎再激活的資料。如果患者出現B型肝炎再激活,應該停止本品的治療,並且在適當的支持治療下採取有效的抗病毒治療。
神經系統
從臨床症狀和/或放射學檢查結果而言,包括本品在內的 TNF拮抗劑極少引起中樞神經系統脫髓鞘病變的發生和惡化,包括多發性硬化、外周脫髓鞘病變包括格林-巴利綜合徵。對以往存在或近期患有中樞及外周神經系統脫髓鞘病變的患者,醫生在給予本品治療時應格外小心。
過敏反應
在臨床研究階段,沒有關於本品皮下注射造成患者過敏反應的嚴重不良事件的報告,因本品造成的非嚴重過敏反應也不常見。在上市銷售後,因使用本品造成的嚴重過敏反應(包括過敏)罕有報導。如果患者出現了過敏反應和其它的嚴重過敏反應,應該立即停止本品用藥,並且採取適當的治療。
在注射器的針頭表面復蓋了天然橡膠(乳膠)。乳膠過敏的患者使用本品可能會發生嚴重的過敏反應。
免疫抑制
在進行本品研究的 64 名類風濕關節炎患者中,沒有跡象表明本品對遲髮型過敏反應、免疫球蛋白的水平產生抑制作用,也不會改變 T 細胞、B 細胞、NK(自然殺傷)細胞、單核細胞/巨噬細胞和中性粒細胞的數量。
惡性疾病和異常淋巴細胞增生
在 TNF 拮抗劑臨床研究的對照部分中,與對照組相比,接受 TNF 拮抗劑治療的患者中出現了惡性病變(包括淋巴瘤),但是發生率很低。上市後有接受 TNF 拮抗劑的患者中出現白血病病例的報導。對於那些長期患有高活動性的炎性病變的類風濕關節炎患者,出現淋巴瘤和白血病的機會增加,上述情況使風險評估變得複雜。根據目前所知,尚不能排除接受 TNF拮抗劑患者罹患淋巴瘤、白血病或其它惡性病變的風險。
包括本品在內的上市後監測發現,一些接受 TNF 拮抗劑治療(治療開始時≤18 歲)的兒童、青少年和年輕的成年人(最多 22 歲)中出現了某些致命的惡性腫瘤, 約有一半為淋巴瘤。其它表現為各種不同的惡性腫瘤,包括罕見的免疫抑制相關的惡性腫瘤。尚不能排除接受 TNF拮抗劑的兒童、青少年出現惡性病變的風險。
上市後,有關於肝脾 T 細胞淋巴瘤的不良反應很罕見。這種罕見的 T 細胞淋巴瘤是一種進展很快的疾病,往往致命。本品合併硫唑嘌呤、6-巰基嘌呤治療炎症性腸道疾病時,在一些年輕的成年患者出現一些肝脾 T 細胞淋巴瘤。應謹慎考慮本品合併硫唑嘌呤、6-巰基嘌呤用藥的潛在風險。所以在使用本品治療的患者中發生肝脾 T 細胞淋巴瘤的風險是不能被排除的。(參見【不良反應】部分)
目前,還沒有對惡性病變患者採用本品治療、或對已經出現惡性疾病的患者繼續進行本品治療的研究。因此,對此類患者進行本品治療時應多加考慮(參見【不良反應】部分)。
對於所有患者,特別是那些曾經接受過廣泛免疫抑制治療,或者銀屑病光化學治療的患者,應該在進行本品治療前檢查皮膚是否出現非黑色素皮膚癌。
在一項探索性臨床研究中,對另外一種 TNF 拮抗劑——英夫利西單抗(infliximab) 進行了評估,結果顯示使用英夫利西單抗的患者與對照組相比,患有嚴重慢性阻塞性肺疾病(COPD)的患者更容易出現惡性病變,而這些病變大多發生在肺部或頭頸部。而所有的患者均具有重度吸菸史。因此,當對 COPD患者使用 TNF拮抗劑時應該加以小心,並且大量吸菸可能會造成患者惡性病變幾率增加。
根據現有數據,尚不清楚阿達木單抗是否對不典型增生或結腸癌的發病風險有影響。所有潰瘍性結腸炎伴不典型增生或結腸癌風險增高的患者(比如,長期潰瘍性結腸炎或原發性硬化性膽管炎患者),或已有不典型增生或結腸癌病史的患者,均應該在給藥前以及整個病程期間,定期進行不典型增生的篩查,評估內容可根據當地治療指南,至少應包括結腸鏡檢查和組織活檢。
血液學反應
在使用 TNF 拮抗劑的病例中,罕有包括再生障礙性貧血在內的全血細胞減少的報告。少數報告了使用本品時出現的血液系統不良反應,其中包括具有臨床意義的血細胞減少(例如血小板減少、白細胞減少)。如果患者出現了惡液質的體徵和症狀(例如,持續發熱、挫傷、出血、皮膚蒼白)應該立即診治。對於那些已經確診血液系統異常的患者,應該立即停止本品的使用。
疫苗接種
在接受阿達木單抗和安慰劑治療的 226 名成年類風濕關節炎受試者中,具有與標準 23價肺炎球菌多糖疫苗 ,以及 3 價流感病毒疫苗相似的抗體反應。尚無在本品治療的患者中活疫苗造成繼發感染傳播的報告。除活疫苗以外,使用本品的患者可以同時接受疫苗接種。
充血性心力衰竭
在另外一項 TNF 拮抗劑的臨床研究中,可以觀察到充血性心力衰竭的惡化,以及由於充血性心力衰竭所造成的死亡率上升。在接受本品治療的患者中,也報告了充血性心力衰竭惡化的病例。對於那些患有輕度心力衰竭(NYHA 分類 I/II 級)的患者,在使用本品時應當加以小心。中重度心力衰竭(參見【禁忌】部分)是本品的禁忌症。如果患者出現充血性心力衰竭的症狀,或者以往的症狀出現惡化應該停止使用本品。
自身免疫過程
本品藥物治療會導致自身抗體的形成。長期使用本品進行治療對自身免疫性疾病的影響尚不清楚。如果在使用本品治療後,患者出現狼瘡樣綜合徵的症狀,並且雙鏈 DNA 抗體陽性時,應該立即停止本品治療(參見【不良反應】部分)。
同時使用TNF拮抗劑和阿那白滯素(anakinra)
在同時使用阿那白滯素和其它 TNF 拮抗劑—依那西普(etanercept)的臨床研究中,觀察到嚴重的感染,並且與單獨使用依那西普比較,不能提高臨床療效。根據依那西普與阿那白滯素聯合使用中出現的不良反應特性,在阿那白滯素與其它 TNF 拮抗劑聯合使用時也可能產生相似毒性。因此,不推薦本品和阿那白滯素聯合使用(參見【藥物相互作用】部分)。
同時使用TNF拮抗劑和阿巴他塞(abatacept)
與單獨使用 TNF 拮抗劑相比,同時使用 TNF 拮抗劑和阿巴他塞增加感染包括嚴重感染的風險,但並不能提高臨床療效。不推薦本品和阿巴他塞聯合使用(參見【藥物相互作用】部分)。
手術
關於接受本品治療患者手術安全性的經驗很有限。在對患者計畫實行手術時,應考慮到阿達木單抗具有較長的半衰期。接受本品治療的患者需要手術時,應該密切關注患者的感染情況,並且採取適當措施。接受本品治療患者的關節成形術安全性經驗也很有限。
小腸梗阻
對克羅恩病治療無效,則表示腸腔內可能存在固定的纖維性狹窄,需要手術治療。現有的數據表明,本品不會造成腸腔狹窄或導致其加重。
老年人群
接受本品治療的 65 歲以上的患者(3.7%)發生嚴重感染的頻率高於 65 歲以下的患者(1.4%)。其中一些還會出現致命的後果。因此,老年患者治療時應特別注意有關的感染風險。
對駕駛和操作機器能力的影響
本品對駕駛和操作機器有輕微的影響。接受本品治療可能會引起頭暈(包括眩暈、視覺障礙和疲勞)(參見【不良反應】部分)。
孕婦及哺乳期婦女用藥
妊娠
目前沒有關於本品對妊娠和哺乳產生影響的臨床數據。
在猴中進行的一項毒理學研究表明,本品不具有母體毒性、胚胎毒性和致畸性。尚無阿達木單抗對幼崽產生出生後毒性以及對生育力影響的臨床前數據(參見【藥理毒理】部分)。
因為本品是 TNF α 抑制劑,因此在妊娠過程中使用會對新生兒的正常免疫反應產生影響。不推薦在妊娠期使用阿達木單抗。建議具有生育可能的女性患者使用適當的避孕方法,避免妊娠,並且在結束本品治療後至少繼續使用該方式 5 個月。
在妊娠期間接受本品的女性,其體內的阿達木單抗可能透過胎盤進入胎兒血清中,從而增加這些嬰兒感染的風險。對於在子宮內暴露於阿達木單抗的嬰兒,不推薦在其母親妊娠期間最後一次注射阿達木單抗後的 5個月內對嬰兒接種活疫苗。
哺乳
尚不清楚阿達木單抗是否可以泌入母乳,或者人體攝入後是否會被吸收。
但是,由於在乳汁中分泌有人體免疫球蛋白,因此女性患者至少在結束治療後 5 個月內不能哺乳。
兒童用藥
目前尚沒有本品在兒童患者中進行的安全性和有效性研究的資料。
老年用藥
參見【用法用量】及【注意事項】。
藥物相互作用
在類風濕關節炎,幼年特發性關節炎和銀屑病關節炎患者中,將本品作為單一藥物治療以及與甲氨蝶呤聯合用藥進行研究。與作為單藥治療相比,本品與甲氨蝶呤同時使用時產生的抗體較低。不使用甲氨蝶呤會造成抗體形成增加,加快清除,減少阿達木單抗療效(參見【藥理毒理】部分)。
不推薦本品和阿那白滯素聯合用藥(參見【注意事項】部分“本品和阿那白滯素聯合用藥”)。
不推薦本品和阿巴他塞聯合用藥(參見【注意事項】部分“本品和阿巴他塞聯合用藥”) 。
由於沒有進行藥物配伍研究,本品不能與其他藥物混合使用。
藥物過量
在臨床研究中,沒有觀察到劑量限制毒性。所評估的最大多次靜脈注射劑量為10mg/kg,大約為推薦劑量的 15 倍。
臨床試驗
 修美樂
修美樂在所有的類風濕關節炎的臨床研究中,共有超過 3000 名患者對本品參加了評估。其中某些患者的治療時間長達 60 個月。在五項隨機、雙盲和嚴格對照的研究中,對本品治療類風濕關節炎的有效性和安全性進行了評估。
在 RA 研究 I 中,對 271 名患者進行了評估,這些患者患有中重度類風濕關節炎,年齡不小於 18 周歲,至少對一種改善病情抗風濕藥治療無效,每周使用 12.5至 25mg 的甲氨蝶呤(如果甲氨蝶呤不能耐受,則使用 10mg)但治療效果不佳,並且每周甲氨蝶呤用量保持在 10 至 25mg。以上患者每兩周皮下注射給以 20,40 或 80mg 的本品或安慰劑,共治療24 周。
在 RA 研究 II 中,對 544 名患有中重度活動期類風濕關節炎的患者進行評估,患者年齡不小於 18 周歲,至少對一種改善病情抗風濕藥治療無效,皮下注射每兩周給以 20 或40mg 本品或者安慰劑,共治療 26 周;或每周皮下注射本品或安慰劑治療,共治療 26 周。不能使用其它改善病情抗風濕藥。
在 RA 研究 III 中,對 619 名患有中重度活動期類風濕關節炎的患者進行評估,患者年齡不小於 18 周歲,每周使用 12.5 至 25mg 的甲氨蝶呤(如果甲氨蝶呤不能耐受,則使用10mg)治療效果不佳。以上患者被分為 3 組,第一組每周使用安慰劑注射治療 52 周,第 2組每周使用本品 20mg 治療 52 周,第 3 組每兩周皮下注射本品 40mg 治療,間隔的一周給予安慰劑治療。此後,患者加入到每兩周使用 40mg 本品的開放研究之中,共使用 60 個月。
在 RA 研究 IV 中,對 636 名患有中重度活動期類風濕關節炎的患者進行初步的安全性評估,患者年齡不小於 18 周歲。參加研究的患者可以從未接受過抗風濕藥物的治療,也可以繼續當前的類風濕治療,但必須至少維持原有治療 28 天。這些治療藥物可以包括甲氨蝶呤、來氟米特、羥基氯喹、柳氮磺胺吡啶和/或氯金酸鈉。患者被隨機分配入每兩周使用40mg 本品或安慰劑組的研究中,共治療 24周。
在 RA 研究 V 中,對從未接受過甲氨蝶呤治療的 799 名中重度早期活動性類風濕關節炎(平均罹患時間小於 9 個月)成年患者進行了評估。本研究旨在比較本品單藥治療、甲氨蝶呤單藥治療或者本品與甲氨蝶呤聯合用藥,在減輕症狀和體徵,以及減慢關節損傷進展的有效性。在這項研究中,本品使用方法為每兩周 40mg ,使用 104周。
RA 研究 I、II 和 III 的主要終點,以及研究 IV 的次要終點是在 24 或 26 周時,達到ACR20 治療反應的患者百分比。研究 V 的主要終點為 52 周時達到 ACR50 治療反應患者的百分比。研究 III 和 V 還具有一個主要終點,為 52 周時病變進展的延緩(通過 X 線結果判斷)。研究 III還有一個主要終點為生活質量改變。
ACR治療反應
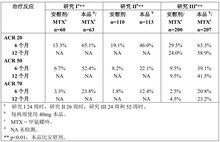
在研究 I、II 和 III 中,接受本品治療的患者達到 ACR20、50 和 70 治療反應的百分比保持一致。表 2 總結了每兩周使用 40mg 本品的治療結果。
表 2 安慰劑對照研究中的 ACR 治療反應(患者百分比)
在 RA 研究 I~IV 中,與安慰劑相比較,所有的 ACR 反應評價標準(關節疼痛和關節腫脹數、患者和醫生對疾病和疼痛的評分、健康評估量表(HAQ)評分以及 CRP(mg/dl)數值)均在 24 或 26 周出現了改善。在研究 III 中,這些改變持續了 52 周。此外,絕大多數患者的 ACR 反應率在隨後參加的開放的擴展期研究中得以保持,並持續至 104 周。在207 名患者中,共有 114 名在 60 個月中連續每兩周使用 40mg 本品。在這些患者中,60 個月時達到 ACR20/50/70治療反應的人數分別為 86、72和 41。
在 RA 研究 IV 中,使用本品加常規藥物治療患者 ACR20 的治療反應顯著優於安慰劑加常規治療的患者(p<0.001)。
在 RA研究 I~IV 中,接受本品治療的患者達到具有統計學意義的 ACR 20 和 50 治療反應所需的時間比安慰劑治療的患者早 1~2周。
RA 研究 V 中從未接受過甲氨蝶呤治療的早期類風濕關節炎患者,與甲氨蝶呤單獨用藥和本品單獨用藥相比,使用本品與甲氨蝶呤聯合治療可以獲得較快的治療反應,在 52 周時具有顯著的 ACR 治療反應,並且在 104 周時這些治療反應保持穩定(見表 3)。
在第 52 周時,接受本品/甲氨蝶呤聯合治療的患者中有 42.9%達到了臨床緩解[患者 28個關節疾病活動得分(DAS28)小於 2.6]的效果,而相比之下,接受甲氨蝶呤單獨給藥治療的患者這一比例為 20.6%,接受本品單獨給藥治療的患者這一比例為 23.4%。對於近期診斷患有中重度類風濕關節炎的患者,本品/甲氨蝶呤聯合用藥治療在臨床和統計學方面顯著優於甲氨蝶呤(p<0.001)和本品單獨用藥(p<0.001),可以使中重度類風濕關節炎患者恢復到較輕的疾病狀態。而兩種單獨給藥治療的療效則相似(p=0.447)。
影像學結果
在 RA 研究 III 中,接受本品治療的患者平均類風濕關節炎患病時間約為 11 年。採用放射學檢查的方式對關節損傷進行評估,得出改良總 Sharp評分(TSS)——評估骨破壞和關節間隙狹窄的改變情況。在第 6 個月和 12 個月時,接受本品/甲氨蝶呤聯合治療的患者與僅使用甲氨蝶呤單獨治療的患者相比較,在放射學檢查方面表現出明顯減緩的病變進展(見表 4)。來自於開放的擴展期研究數據表明,關節結構損壞進程的減慢可以持續 60 個月。在第 5 年時,對 207 名每兩周接受 40mg 本品治療患者中的 113 名進行了放射學檢查評估。在這些患者中,有 66 名未出現關節結構損壞的進展,表現為 TSS 分值變化為 0 或者較低。
在 RA 研究 V 中,採用放射學檢查方式對關節損傷進行評估,並且得出 TSS(見表5)。
在治療 52 周和 104 周后,與甲氨蝶呤單獨給藥(分別為 37.4%和 33.5%,p<0.001)和本品單獨給藥(分別為 50.7%,p<0.002 和 44.5%,p<0.001)相比較,採用本品/甲氨蝶呤聯合用藥治療患者病變無進展的百分比(分別為 63.8% 和 61.2%)升高(與基線比較骨質破壞的改良 SHARP 不超過 0.5)。
在四個嚴格對照的研究中,使用健康評估量表(HAQ)對患者健康相關的生活質量和身體機能進行評估,這是研究 III 中預先確定的 52 周時評估的主要終點。與安慰劑組相比,四個研究中使用本品的各組均表現顯著的 HAQ評分改善;而在第 52周,研究 III中觀察到了同樣的結果;簡明健康調查表(SF 36)的結果、具有顯著統計學意義的生理健康評分(PCS)以及顯著統計學意義的疼痛及活動性評分也支持同樣的結果。在研究 I,III 和 IV中,通過慢性疾病治療評分(FACIT)評估,患者的疲勞度下降。
在 RA研究 III中,患者身體機能的改善一直持續到開放研究的第 260周(60個月)。對生活質量改善的監測長達 156 周(36 個月),這段時間內改善持續存在。
在 RA 研究 V 第 52 周時,本品/甲氨蝶呤聯合用藥與甲氨蝶呤和本品單獨用藥相比,HAQ 與身體機能 SF36 的評分較高(p<0.001),這種情況一直持續至 104周。
在一項多中心、隨機、雙盲、安慰劑對照的臨床研究中,對 302 名患有中重度類風濕關節炎並同時伴隨甲氨碟呤治療的中國受試者進行了研究。本研究結果表明中國人群和西方人群的有效性和安全性具有可比性。在接受 40mg 本品治療的受試者中,57.0%的患者在12 周獲得了 ACR20 反應(相對於安慰劑,P=0.004),這是本研究有效性評價的主要指標。在接受 80mg 本品治療的受試者中,51.2%的患者在 12 周獲得了 ACR20 反應(相對於安慰劑,P=0.026)。有效性的次要指標 ACR50 和 ACR70 以及 ACR 各項應答(例如晨僵,腫脹關節計數,健康評估量表以及 CRP 數值)都表明,中國患者和西方患者對本品的應答水平相同。接受 40mg 本品治療的受試者在揭盲之後,每隔一周仍然持續使用本品直至 24 周。其中在雙盲研究中,接受過本品治療的患者在揭盲後至 24 周仍然保持同樣的應答率,對照組患者的應答也提高到與最初接受本品治療的患者一樣。
在兩組隨機、為期 24周的雙盲、安慰劑對照研究中,對 393名常規治療效果不佳的活動性強直性脊柱炎(所有組別中疾病活動性[Bath 強直性脊柱炎疾病活動指數(BASDAI)]的平均值為 6.3)的患者每兩周給予本品 40mg 進行治療評價。其中 79 名患者(20.1%)合併使用改善疾病抗風濕藥物治療,37(9.4%)名患者合併使用糖皮質激素治療。在雙盲試驗之後進行了開放試驗期,患者每兩周接受 40mg 本品皮下注射,持續 28 周。在 12,16或 20 周,沒有達到 ASAS20 的受試者(n=215,54.7%)退出開放的每兩周 40mg 本品皮下注射試驗,隨後作為雙盲統計學分析研究中的無反應者接受治療。
在 315 名患者的大樣本 AS研究中(研究 I),與安慰劑治療相比,接受本品治療的患者顯示強直性脊柱炎的症狀和體徵明顯改善。第 2周即可觀察到顯著的治療反應,並持續至第 24周(表 6)。
在 SF36 和強直性脊柱炎生活質量問卷(ASQoL)方面,接受本品治療的患者的症狀在第 12周出現了顯著的改善,並維持至第 24 周。
在 82 名成年活動期強直性脊柱炎患者的小範圍、雙盲、隨機、安慰劑對照 AS 研究中(研究 II)也表現出相似的趨勢(不全部具有統計學顯著性)。
在一項多中心、隨機、雙盲、安慰劑對照的臨床研究中,對 344名患有活動性強直性脊柱炎且對至少 1種非類固醇類抗炎藥物治療(NSAID)療效不佳或無法耐受的中國成年受試者進行了研究。本研究結果表明中國人群與西方人群的有效性和安全性具有可比性。在接受 40mg 本品治療的受試者中,67.2%的患者在第 12 周獲得了有效性的主要指標ACR20應答(相對於安慰劑,P 值<0.001),高於西方受試者(58.2%和 47.4%)。而有效性的次要指標如 ASAS40、ASAS50 和 ASAS70 應答率、BASDAI50(Bath強直性脊柱炎疾病活動性指數)應答率、ASAS5/6 標準、部分緩解反應、C反應蛋白(CRP)、BASMI2(兩步法 Bath 強直性脊柱炎測量指數)和 MASES(Maastricht 強直性脊柱炎附著點炎評分)均表明,中國患者和西方患者對本品的應答水平相同。揭盲後又進行了開放性試驗期,患者接受 40mg 本品隔周一次治療持續 12 周。雙盲階段接受過本品的受試者在揭盲後,其ASAS40/50/70 應答率、ASAS5/6 應答率、ASAS部分緩解率和 BASDAI50應答率至第 24周均有增加,且對 C反應蛋白、BASMI2 和 MASES的應答率均保持原有水平。原安慰劑
組受試者對本品的應答率也提高到與最初接受本品治療的受試者一樣。
接受本品治療的受試者組,在第 12 周的強直性脊柱炎活動分數(ASDAS)總分、患者總體評分(PTGA)–疼痛分數、ASDAS 病情非活動狀態分類、BASMIlin(線性法BASMI指數)、HAQ-S(針對脊椎關節病修改的健康狀況調查問卷)總分以及 WPAI-SHP(工作能力及活動障礙指數-特別健康問題)(出勤率、對工作能力的整體影響、活動障礙)評分等的結果在統計學上均顯著優於安慰劑組,這再次表明阿達木單抗能有效地緩解強直性脊柱炎患者的症狀和體徵。
免疫原性
抗阿達木單抗抗體的形成與藥物清除的增加以及阿達木單抗效力下降有關。抗阿達木單抗抗體與不良反應之間沒有明顯相關性。
在 RA 研究 I、II 和 III 6~12 個月內對抗阿達木單抗抗體進行了多時間點檢測。在關鍵性臨床實驗研究中,接受阿達木單抗治療的 1053 名患者中有 58 名(5.5%)檢測到阿達木單抗抗體,而相比之下安慰劑組為 2/370(0.5%)。沒有聯合使用甲氨蝶呤的患者組別中,該比例為 12.4%;阿達木單抗與甲氨蝶呤合用時,該比例為 0.6%。
在強直性脊柱炎患者中,接受阿達木單抗治療的患者中抗阿達木單抗抗體的檢出率為8.3%(17/204)。在沒有聯合使用甲氨蝶呤的患者中,檢測率為 8.6%(16/185),而甲氨蝶呤加用阿達木單抗時則為 5.3%(1/19)。
由於免疫原性分析具有產品特異性,因此不宜將抗體出現比例與其它產品相比較。
藥理毒理
阿達木單抗可以與 TNF特異性結合,通過阻斷 TNF 與 p55 和 p75 細胞表面 TNF受體的相互作用從而消除其生物學功能。
阿達木單抗還可以調節由 TNF 介導或調控的生物學效應,包括改變對白細胞遊走起到重要作用的粘附分子的水平(ELAM-1,VCAM-1 和 ICAM-1,半數抑制濃度為0.1~0.2nM)。
類風濕關節炎患者接受本品治療後,與基線水平相比較,急性期炎性反應物(C 反應蛋白(CRP)、紅細胞沉降率(ESR))和血清細胞因子(IL-6)水平快速下降。導致組織重塑並使軟骨破壞的基質金屬蛋白酶(MMP-1 和 MMP-3)的血清水平也會出現下降。接受本品治療的患者通常會出現慢性炎症的血液學指標改善。
遺傳毒性:遺傳毒性試驗沒有發現阿達木單抗可能對人體產生特殊的危害。
生殖毒性:在短尾猴胚胎-胎仔發育/圍產期發育毒性研究中,阿達木單抗劑量達到 30和 100mg/kg(每組 9~17隻猴)時,沒有對胎仔造成危害。
藥代動力學
在皮下注射單劑量 40 mg 本品後,阿達木單抗的吸收和分布緩慢,在給藥後 5 天達到血清峰濃度。在三組研究中,採用 40 mg 單劑量給藥後,阿達木單抗的絕對生物利用度平均為 64%。以 0.25至 10 mg/kg 的濃度範圍進行單劑量靜脈注射後,其濃度呈劑量依賴性。使用 0.5 mg/kg(~ 40mg)的劑量注射後,清除範圍從 11 至 15 ml/小時,穩態表觀分布容積(Vss)為 5~6升,平均末相清除半衰期大約為 2周。幾例類風濕關節炎患者關節滑液中阿達木單抗的濃度為血清中濃度的 31~96%。
每兩周皮下注射 40mg 本品後,類風濕關節炎患者穩態時平均濃度分別為 5μg/ml(未聯合使用甲氨蝶呤)和 8~9μg/ml(聯合使用甲氨蝶呤)。血清中阿達木單抗在穩態時濃度隨著每兩周 20、40 和 80mg 以及每周皮下注射的劑量成比例增長。
總體藥物動力學分析的數據來自於 1300 名類風濕關節炎的患者,趨勢表明隨著患者體重的增加阿達木單抗的清除率升高。在具有可測定 AAA(抗阿達木單抗抗體)的患者中,血清游離阿達木單抗(沒有與 AAA 結合)的水平較低。沒有在兒童患者或肝腎功能不良的患者中對本品進行該項研究。
一項對24位患有輕度類風濕關節炎的中國受試者進行的藥代動力學研究,評估了單劑量皮下注射阿達木單抗的藥代動力學特徵(40mg和80mg),並且與白種人的藥代動力學結果比較。該研究表明,中國受試者的阿達木單抗血藥濃度-時間曲線和其它藥代動力學參數與白種人相似,其中達峰濃度(Cmax) 和曲線下面積(AUC)在中國受試者中稍高。未測得陽性抗阿達木單抗抗體(AAA)的血樣。
貯藏
在冰櫃內儲存(2~8℃),注射器或藥物應保存在包裝盒內,不能進行冷凍。
包裝
在帶有針套的預充式注射器中裝有含 40mg 本品(阿達木單抗)的注射用溶液。
在發泡包裝內含有一支帶有針套的預充式注射器(0.8ml 無菌溶液),附一個酒精棉擦。
包裝規格:1)1 支/盒,2)2支/盒。
預裝注射器;40mg/0.8ml
生產企業
Vetter Pharma-Fertigung GmbH & Co. KG
修訂日期
2010年07月05日 2011年11月30日 2013年03月29日 2013年11月27日
適應證現狀
據估計,中國強直性脊柱炎患者為400萬,發病率在0.1%~0.4%之間,年輕人容易遭受強直性脊柱炎的侵襲,發病期一般在20~30歲;目前在中國,約有500萬名類風濕關節炎患者正承受著病痛的折磨,患病率已經達到了0.2%~0.4%。
中華醫學會風濕病學分會主任委員、北京協和醫院風濕免疫科主任醫師曾小峰解釋說:“強直性脊柱炎也是年輕人頑固性背痛最易被忽視的原因之一,強直性脊柱炎最終可導致完全的脊柱融合,造成軀體活動嚴重受限,最終降低整體健康狀況和生活質量。”
中國人民解放軍總醫院風濕科主任、全軍風濕病專科中心主任黃烽教授分享說“對於類風濕關節炎來說,成功的治療策略是早期積極治療。目前市場上治療的手段非常多,因此規範治療尤為重要。近年來,生物類抗風濕藥開始出現,如艾伯維公司的修美樂®(阿達木單抗),它是全球首個被批准的腫瘤壞死因子(TNF)-α全人源單克隆抗體。與傳統的藥物相比,這類藥物的療效強效持久,能有效緩解疾病症狀、抑制影像學進展及保留關節功能,且安全性良好,適用於各種類風濕關節炎患者。這種藥物一般與甲氨蝶呤合併使用,大大提高了治療效果。這個針對腫瘤壞死因子的藥物,正在成為生物類抗風濕藥中的領軍者。”
修美樂早在2010年便在中國獲批治療類風濕關節炎,此前修美樂在全球範圍內已擁有10個適應證及長達16年的臨床試驗經驗。2013年,修美樂在中國獲得國家食品藥品監督管理總局批准治療強直性脊柱炎,目前,全球88個國家和地區已有超過67萬名患者正在接受修美樂治療。

