簡介
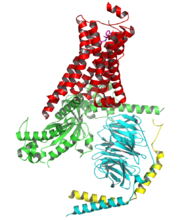
 人κ-阿片肽受體與JDTic的複合物
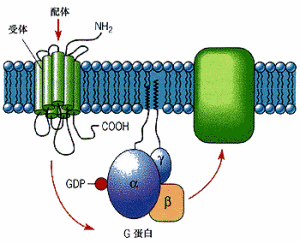
人κ-阿片肽受體與JDTic的複合物G蛋白偶聯受體(G Protein-Coupled Receptors, GPCRs),是一大類膜蛋白受體的統稱。這類受體的共同點是其立體結構中都有七個跨膜α螺鏇,且其肽鏈的C端和連線(從肽鏈N端數起)第3和第4個跨膜螺鏇的胞內環(第二個胞內環)上都有G蛋白(鳥苷酸結合蛋白)的結合位點。目前為止,研究顯示G蛋白偶聯受體只見於真核生物之中,而且參與了很多細胞信號轉導過程。在這些過程中,G蛋白偶聯受體能結合細胞周圍環境中的化學物質並激活細胞內的一系列信號通路,最終引起細胞狀態的改變。已知的與G蛋白偶聯受體結合的配體包括氣味,費洛蒙,激素,神經遞質,趨化因子等等。這些受體可以是小分子的糖類,脂質,多肽,也可以是蛋白質等生物大分子。一些特殊的G蛋白偶聯受體也可以被非化學性的刺激源激活,例如在感光細胞中的視紫紅質可以被光所激活。與G蛋白偶聯受體相關的疾病為數眾多,並且大約40%的現代藥物都以G蛋白偶聯受體作為靶點。
G蛋白耦聯受體的下游信號通路有多種。與配體結合的G蛋白耦聯受體會發生構象變化,從而表現出鳥苷酸交換因子(GEF)的特性,通過以三磷酸鳥苷(GTP)交換G蛋白上本來結合著的二磷酸鳥苷(GDP)使G蛋白的α亞基與β、γ亞基分離。這一過程使得G蛋白(特別地,指其與GTP結合著的α亞基)變為激活狀態,並參與下一步的信號傳遞過程。具體的傳遞通路取決於α亞基的種類(Gαs,Gαi/o,Gαq/11,Gα12/13).其中兩個主要的通路分別涉及第二信使環腺苷酸(cAMP)和磷脂醯肌醇。參見AC系統(腺苷酸環化酶系統)。
結構
 G蛋白偶聯受體
G蛋白偶聯受體G蛋白偶聯受體均是膜內在蛋白(Integral membrane protein),每個受體內包含七個α螺鏇組成的跨膜結構域,這些結構域將受體分割為膜外N端(N-terminus),膜內C端(C-terminus),3個膜外環(Loop)和3個膜內環。受體的膜外部分經常帶有糖基化修飾。膜外環上包含有兩個高度保守的半胱氨酸殘基,它們可以通過形成二硫鍵穩定受體的空間結構。有些光敏感通道蛋白(Channelrhodopsin)和G蛋白耦聯受體有著相似的結構,也包含有七個跨膜螺鏇,但同時也包含有一個跨膜的通道可供離子通過。
與G蛋白偶聯受體相似,脂聯素受體(例如ADIPOR1和ADIPOR2)也包含七個跨膜域,但是它們以相反的方向跨於膜上(即N端在膜內而C端在膜外),並且它們也不與G蛋白相互作用。
早期關於G蛋白偶聯受體結構的模型是基於他們與細菌視紫紅質(Bacteriorhodopsin)之間微弱的相似(Analogy)關係的,其中後者的結構已由電子衍射(蛋白質資料庫資料編號:PDB2BRD和PDB1AT9)和X射線晶體衍射(PDB1AP9)實驗所獲得。在2000年,第一個哺乳動物G蛋白偶聯受體——牛視紫紅質的晶體結構(PDB1F88)被解出。2007年,第一個人類G蛋白耦聯受體的結構(PDB2R4R和PDB2R4S)被解出。隨後不久,同一個受體的更高解析度的結構(PDB2RH1)被發表出來。這個人G蛋白耦聯受體——β2腎上腺素能受體,顯示出與牛視紫紅質的高度相似,不過兩者在第二個膜外環的構象上完全不同。由於第二膜外環組成了一個類似蓋子的結構罩住了配體結合位點,這個構象上的區別使得所有對從視紫紅質建立G蛋白耦聯受體同源結構模型的努力變得困難重重。
一些激活的即結合了配體的G蛋白耦聯受體的結構也已經被研究清楚。這些結構顯示了G蛋白耦聯受體的膜外部分與配體結合了之後會導致膜內部分發生構象變化。其中最顯著的變化是第五和第六跨膜螺鏇之間的膜內環會向外移動,而激活的β2腎上腺素能受體與G蛋白形成的複合體的結構顯示了G蛋白α亞基正是結合在了上述運動所產生的一個空穴處。
激活
胞內部分有G蛋白結合區。G蛋白α,β,γ三種亞單位組成的三聚體,靜息狀態時與GDP結合.當受體激活時GDP-αβγ複合物在Mg2+參與下,結合的GDP與胞質中GTP交換,GTP-α與βγ分離並激活效應器蛋白,同時配體與受體分離。α亞單位本身具有GTP酶活性,促使GTP水解為GDP,在與βγ亞單位形成G蛋白三聚體恢復原來的靜息狀態。
諾貝爾獎
台北時間2012年10月10日下午5點45分,2012年諾貝爾化學獎揭曉, 兩位美國科學家羅伯特·萊夫科維茨(Robert J. Lefkowitz)和布萊恩·克比爾卡(Brian K. Kobilka)因“G蛋白耦聯受體研究”獲獎。
Brian K. Kobilka美國史丹福大學醫學院的教授,分子和細胞生理學和醫學博士。他也是ConfometRx,一家專注於G-蛋白耦聯受體的生物技術公司的共同創辦人。2011年入選美國國家科學院院士。G蛋白耦聯受體最新研究成果:今年Kobilka教授領導組成的國際研究團隊一連公布了三篇論文,報導了G蛋白耦聯受體(GPCR)作用複合物的詳細晶體結構,這一發現被稱為是一項真正具有突破意義的成果。G蛋白耦聯受體(GPCR)是與G蛋白有信號連線的一大類受體家族,是最著名的藥物靶標分子,調控著細胞對激素,神經遞質的大部分應答,以及視覺,嗅覺,味覺等。目前世界藥物市場上至少有三分之一的小分子藥物是GPCR的激活劑或者拮抗劑,據報導,目前上市的藥物中,前50種最暢銷的藥物20%就屬於G蛋白受體相關藥物,比如充血性心力衰竭藥物Coreg,高血壓藥物Cozaar,乳腺癌藥物Zoladex等等。
由於GPCR屬於膜蛋白——穿插細胞膜多達7次,而且構象形態多,因此其結構生物學分析不容易開展,而這篇文章完成了GPCR跨膜信號作用複合物的X-射線晶體結構,實現了許多人未能完成的任務,正如密蘇里州大學的Stephen Sprang所說的那樣:這是一篇真正具有突破意義的文章,多年以來,我們這行里的人都在夢想得到這個結構圖,因為它最終會告訴我們GPCR受體是如何發揮作用的。在這篇文章中,研究人員利用X線晶體成像技術(X-ray crystallographic)對與G蛋白耦聯的β2腎上腺素能受體複合物進行了研究,據報導,G蛋白是一種由三個不同亞單位組成的蛋白,它很容易與GPCR蛋白分開,並且解離成三個獨立的亞單位,而且這個複合物的大小大約是β2腎上腺素能受體蛋白的2倍。如果要拿到β2腎上腺素能受體蛋白——G蛋白複合物的晶體結構首先就得開發出純化該複合物並且讓它穩定存在的新技術,比如讓複合物與抗體結合,或者對數千種不同的結晶條件進行系列實驗等等。
另外一篇Nature文章則介紹了利用“肽醯胺氫-氘交換質譜”對這一信號作用複合物的蛋白動態所做的探測研究,同期Nature雜誌還發表了特寫文章“It's all about the structure”,稱要確定這些複合物的結構特別具有挑戰性。不過也有科學家表示,由於這項研究實驗採用的是經過人工改造的,並且與抗體結合的GPCR蛋白複合體,這可能不能反應天然蛋白的真實情況。對此,Kobilka等人則認為他們已經做過蛋白功能實驗,實驗結果表明他們使用的蛋白與天然蛋白在功能上沒有差異。
領導這項研究的是著名的結構生物學,史丹福大學Brian K. Kobilka教授,他曾2007年與另外一位科學家Raymond C. Stevens,利用T4溶菌酶融合蛋白方法解析了第一個非視紫紅質GPCR晶體結構:人β2腎上腺素受體,這篇發表在Sciene上的文章被引上千次,後來他還獨立地通過抗體片段介導法解析了人β2腎上腺素受體的結構。