基本蛋白質變性的定義
蛋白質變性(protein denaturation):蛋白質在某些物理和化學因素作用下其特定的空間構象被破壞,從而導致其理化性質的改變和生物活性的喪失,這種現象稱為蛋白質變性。
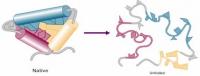 蛋白質變性
蛋白質變性蛋白質結構
蛋白質是由多種胺基酸通過肽鍵構成的高分子化合物,在蛋白質分子中各胺基酸的結合順序稱為一級結構:蛋白質的同一多肽鏈中的氨基和醯基之間可以形成氫鍵,使得這一多肽鏈具有一定的構象,這些稱為蛋白質的二級結構;多肽鏈之間又可互相扭曲摺疊起來構成特定形狀的排列稱為三級結構,三級結構是與二硫鍵、氫鍵等聯繫著的
蛋白質變性的原因
變性作用是蛋白質受物理或化學因素的影響,改變其分子內部結構和性質的作用。一般認為蛋白質的二級結構和三級結構有了改變或遭到破壞,都是變性的結果。能使蛋白質變性的化學方法有加強酸、強鹼、重金屬鹽、尿素、乙醇、丙酮等;能使蛋白質變性的物理方法有加熱、紫外線照射、劇烈振盪等。
蛋白質變性後的方面
(一)生物活性喪失
蛋白質的生物活性是指蛋白質所具有的酶、激素、毒素、抗原與抗體、血紅蛋白的載氧能力等生物學功能。生物活性喪失是蛋白質變性的主要特徵。有時蛋白質的空間結構只有輕微變化即可引起生物活性的喪失。
(二)某些理化性質的改變
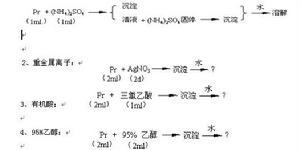 蛋白質變性
蛋白質變性蛋白質變性後理化性質發生改變,如溶解度降低而產生沉澱,因為有些原來在分子內部的疏水基團由於結構鬆散而暴露出來,分子的不對稱性增加,因此粘度增加,擴散係數降低。
(三)生物化學性質的改變
蛋白質變性後,分子結構鬆散,不能形成結晶,易被蛋白酶水解。蛋白質的變性作用主要是由於蛋白質分子內部的結構被破壞。天然蛋白質的空間結構是通過氫鍵等次級鍵維持的,而變性後次級鍵被破壞,蛋白質分子就從原來有序的捲曲的緊密結構變為無序的鬆散的伸展狀結構(但一級結構並未改變)。所以,原來處於分子內部的疏水基團大量暴露在分子表面,而親水基團在表面的分布則相對減少,至使蛋白質顆粒不能與水相溶而失去水膜,很容易引起分子間相互碰撞而聚集沉澱。
物理變化與化學變化
引起蛋白質變性的原因可分為物理和化學因素兩類。物理因素可以是加熱、加壓、脫水、攪拌、振盪、紫外線照射、超音波的作用等;化學因素有強酸、強鹼、尿素、重金屬鹽、十二烷基磺酸鈉(SDS)等。在臨床醫學上,變性因素常被套用於消毒及滅菌。反之,注意防止蛋白質變性就能有效地保存蛋白質製劑。蛋白質的變性很複雜,要判斷變性是物理變化還是化學變化,要視具體情況而定。如果有化學鍵的斷裂和生成就是化學變化;如果沒有化學鍵的斷裂和生成就是物理變化。 重金屬鹽使蛋
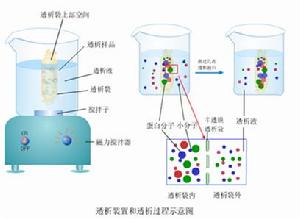 蛋白質變性
蛋白質變性強酸、強鹼使蛋白質變性,是因為強酸、強鹼可以使蛋白質中的氫鍵斷裂。也可以和游離的氨基或羧基形成鹽,在變化過程中也有化學鍵的斷裂和生成,因此,可以看作是一個化學變化。
尿素、乙醇、丙酮等,它們可以提供自己的羥基或羰基上的氫或氧去形成氫鍵,從而破壞了蛋白質中原有的氫鍵,使蛋白質變性。但氫鍵不是化學鍵,因此在變化過程中沒有化學鍵的斷裂和生成,所以是一個物理變化。
加熱、紫外線照射、劇烈振盪等物理方法使蛋白質變性,主要是破壞蛋白質分子中的氫鍵,在變化過程中也沒有化學鍵的斷裂和生成,沒有新物質生成,因此是物理變化。否則,雞蛋煮熟後就不是蛋白質了。而我們知道,熟雞蛋依然有營養價值,其中的蛋白質反而更易為人體消化系統所分解吸收。
相關:蛋白質復性
蛋白質在受到光照、熱、有機溶劑以及一些變性劑的作用時,次級鍵受到破壞,導致天然構象的破壞,使蛋白質的生物活性喪失。如果變性條件劇烈持久,蛋白質的變性是不可逆的。如果變性條件不劇烈,這種變性作用是可逆的,說明蛋白質分子內部結構的變化不大。這時,如果除去變性因素,在適當條件下變性蛋白質可恢復其天然構象和生物活性,這種現象稱為蛋白質復性(renaturation)。例如胃蛋白酶加熱至80~90℃時,失去溶解性,也無消化蛋白質的能力,如將溫度再降低到37℃,則又可恢復溶解性和消化蛋白質的能力。
蛋白質變性的套用價值
1、雞蛋、肉類等經加溫後蛋白質變性,熟後更易消化。
2、細菌、病毒加溫,加酸、加重金屬(汞)因蛋白質變性而滅活(滅菌、消毒)。
3、動物、昆蟲標本固定保存、防腐。
4、很多毒素是動物蛋白質,加甲醛固定,減毒、封閉毒性鹼基團作類毒素抗原,製作抗毒素。
5、製革,使皮革成形。
6、蠶絲是由蛋白質變性而成。
7、用於蛋白質的沉澱。從血液中提分離、提純激素,製藥。
8、臨床上外科凝血,止血。尿中管型診斷腎臟疾病。
9、酶類分解各種蛋白質,以利於腸壁對營養物質的吸取。
10、加入電解質使蛋白質凝聚脫水如做豆腐。
11、改變蛋白質分子表面性質進行鹽析,層析分離提純蛋白質,如核酸的提純、DNA測定。
12、大分子的破碎,基因重整合。
13、蛋白質分子結合重金屬而解毒。
14、蛋白質分子與某些金屬結合出現顯色反應,如雙縮脲反應可測定含量。
15、用於蛋白純化中雜蛋白的沉澱。