定義
熱容(heatcapacity)熱容的標準定義是:“當一系統由於加給一微小的熱量δQ而溫度升高dT時,δQ/dT這個量即是熱容。”(GB3102.4-93)
熱容是當物質吸收熱量溫度升高時,溫度每升高1K所吸收的熱量稱為該物質的熱容。
系統的溫度升高1K所需的熱稱為該系統的熱容(符號C,單位J/K)。
熱容是一個廣度量,如果升溫是在體積不變條件下進行,該熱容稱為等容熱容,如果升溫是在壓力不變條件下進行,該熱容稱為等壓熱容。單位質量物體的熱容稱為比熱容。設物體的溫度由T1K升高至T2K時吸熱為Q,則Q/(T2-T1)稱為T1至T2溫度間隔內的平均熱容(averageheatcapacity)。
由於物體在不同溫度時升高1K所需熱不同,因此在某一溫度T時物體的熱容C的嚴格定義是(見圖)lim代表T2趨近於T1的極限,δQ表示無限小量熱比區別於狀態函式的全微如dT。
物質的熱容理論
一.氣體的熱容:
 熱容
熱容在常溫下,氣體物質的核,電子,振動運動對比熱的貢獻不大,氣體物質主要考慮平動、轉動對熱容的貢獻。
平動:Ut=3/2RT
CV,m=(∂U/∂T)V=3/2R
二維轉動:Ur=NkT2(∂/∂T)ln(T/r)
=NkT2(1/T)=NkT
CV.m=(∂U/∂T)V=Nk=R
單原子分子: CV.m=3/2R;Cp.m=5/2R; =5/3
線性分子:CV.m=5/2R;Cp.m=7/2R; =1.4
非線性分子:CV.m=3R; Cp.m=4R; =4/3
但在高溫下,振動運動也將充分展開,需考慮振動運動對氣體熱容的貢獻。
二.晶體熱容:
人們發現晶體的比熱為一常數,且溫度愈高,其比熱愈趨近於此經典值;在極低溫度下,物質的比熱與溫度的三次方成正比。
A.Dulong-Petit定律:
CV.m=3R=24.9J·K-1·mol-1
B. CV∝T3(T→0K)
用經典統計力學對晶體的比熱現象無法作出合理的解釋,愛因 斯坦首先將量子理論引入固體理論。Einstein理論:
(1)Einstein認為晶體為一個巨大的分子,若體系含N個原子, 每個原子的運動自由度為3,故晶體的運動自由度等於3N。
熱容研究
物體在某一過程中,每升高(或降低)單位溫度時從外界吸收(或放出)的熱量。如傳遞的熱量為 ΔQ溫度改變ΔT時,物體在該過程中的熱容C被定義為
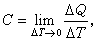
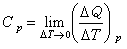 ,
,
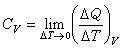 ,
,
 熱容
熱容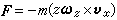
式中H和U為系統的態函式焓和內能。CP0和Cv均可由實驗測出,因為實驗裝置中固定壓強較為容易,所以通常測量的是定壓熱容,而定容熱容是通過測量等壓膨脹係數α 及等溫壓縮係數 k,利用關係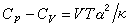 而得到(V 為物體的體積,T 為熱力學溫度)。對氣體來說,還可測量出CP0和Cv的比值γ,套用γ=CP0/ Cv,計算得到Cv。
而得到(V 為物體的體積,T 為熱力學溫度)。對氣體來說,還可測量出CP0和Cv的比值γ,套用γ=CP0/ Cv,計算得到Cv。
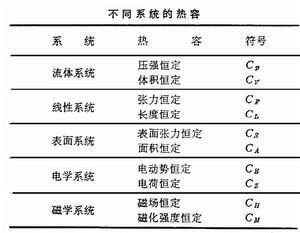
各種不同的系統在一定條件下,有其各自的熱容,列表如下:
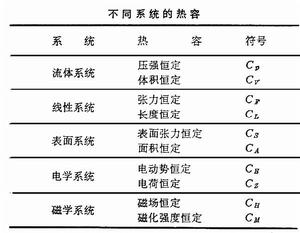 熱容
熱容表中每一種熱容均是兩個參量的函式,當狀態變化的範圍較小時,熱容實際上可視為常數。當溫度趨於絕對零度時,各種物質的熱容都趨近於零。
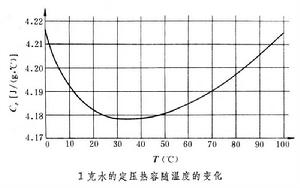
對於單元二相系,還可以引入二相平衡熱容的概念。以C娝表示相1的二相平衡熱容,其定義是在加熱過程中保持相1同相2平衡的條件下,使處於相1的物質溫度升高1K所吸收的熱量。C姟表示相2的二相平衡熱容,即在加熱過程中保持相2同相1平衡,使處於相2的物質溫度升高1K所吸收的熱量。計算表明,一定質量水的二相平衡熱容同水的定壓熱容相差很少。