基本內容
活化
activation
(一)又稱激發(excitation)。粒子(如原子或離子),從外界獲得足夠能量後,其電子由較低的基態能級躍遷到較高能級的過程。一個分子是否為活化分子依不同的速率理論及反應而標準不同,如碰撞理論中為分子能量ε>ε0(閾能)的分子為活化分子,活化分子也不一定是過渡態,如單分子理論中的賦能分子。活化方式有碰撞傳能活化及光活化等多種方式。
另外活化也常指某一物質從其無活性狀態轉變為具有活性狀態的過程。其中也包括生物細胞或孢子在休眠後進入重新生長狀態,例如:金屬催化劑的活化,即為從其氧化物狀態轉變為金屬狀態的過程。生物孢子在適宜的生長環境中在次繁殖。
(二)活化作用。
活化能量
非活化分子轉變為活化分子所需吸收的能量。溫度對反應速率有顯著影響。在多數情況下,其定量規律可由阿倫尼烏斯公式來描述:
κ=Ae-E/RT(1)式中κ為反應的速率系(常)數;E和A分別稱為活化能和指前因子,是化學動力學中極重要的兩個參數;R為摩爾氣體常數;T為熱力學溫度。對於更為複雜的描述κ與T的關係式中,活化能E定義為:
E=RT2(dlnκ/dT)(2)
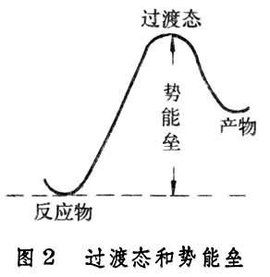
在元反應中,並不是反應物分子的每一次碰撞都能發生反應。S.A.阿倫尼烏斯認為,只有“活化分子”之間的碰撞才能發生反應,而活化分子的平均能量與反應物分子平均能量的差值即為活化能。近代反應速率理論進一步指出,兩個分子發生反應時必須經過一個過渡態——活化絡合物,過渡態具有比反應物分子和產物分子都要高的勢能,互撞的反應物分子必須具有較高的能量足以克服反應勢能壘,才能形成過渡態而發生反應,此即活化能的本質。
式(1)可寫成:
lnκ=lnA-E/RT(3)根據式(3),由實驗測出不同溫度下的κ值,並將lnκ對1/T作圖,即可由所得直線的斜率求出E值。也可將由實驗歸納出的κ與T的經驗關係式直接代入式(2)求得E值。
對於複合反應,由上述實驗方法求出的E值只是表觀值,沒有實際的物理意義。
活化影響
如果活化不好原因可能是能量值沒又達到臨界值,或者是沒有滿足活化的所有條件。這時解決的辦法有添加催化劑等,或者直接達到應有條件要求。
活化方法
活化的目的是在經過粗化處理的塑膠製件表面吸附一層具有催化活性的貴金屬,如銀、金、鈀等,作為化學鍍的催化中心,使化學鍍的還原反應能夠在塑膠表面迅速均勻地進行,所以活化的好壞直接決定著化學鍍的成敗。
活化的方法常用的有分步活化和一步活化法。
(1)分步活化法:分步活化法是使塑膠表面浸潤一層具有還原作用的金屬鹽溶液(敏化),通常是氯化亞錫(SnCl2·2H2O),然後再在貴金屬鹽的溶液里還原出催化中心(活化),通常是硝酸銀溶液,也有氯化鈀溶液。
其工藝規範如下。
敏化液:SnCl2·2H2O
10g/L
HCl
40mL/L
錫條
1根
溫度
室溫
時間
5-15 min
活化:①AgNO3
1-3g/L
NH4OH
加至溶液透明
溫度
室溫
時間
5-15 min
②PdCl2
0.5-1g/L
HCl
20-30mL/L
注意硝酸銀要用蒸餾水配製,且進入活化前要用蒸餾水清洗。
(2)一次活化法:一步活化法是使催化金屬還原出來並形成膠體,一次浸潤在塑膠表面,經解膠後即有活性,常用的是膠體鈀法,工藝規範如下。
PdCl2
1g/L
HCl
300mL/L
SnCl2·2H2O
38g/L
溫度
室溫
時間
5-10min
解膠:HCl
80-120mL/L
溫度
室溫
時間
3-5min
這兩種方法比較起來,第一種活化法材料來源較為廣泛,價格便宜,便溶液的穩定性差,且銀只對化學鍍銅有催化作用,對化學鍍鎳則無能為力。採用鈀活化的方法價格較貴,但溶液穩定性好,且對化學鍍銅及化學鍍鎳均有很好的催化效果,所以鍍層的附著力強,產品合格率高 ,質量可靠。
但是在實際生產中,無論採用哪種活化方法都會遇到活化不好的情況,這是什麼原因呢?實踐經驗表明:除了粗化不夠以外,大多數是由於活化液配製不當或者操作不仔細、溶液維護不好造成的。
對於採用氯化亞錫敏化、硝酸銀活化的方法來說,配製敏化液時,應先放鹽酸於少量水中,再加入氯化亞錫使之溶解,最後稀釋到規定的體積,不可顛倒次序,否則,容易因氯化亞錫的水解而使配製失敗。即
SnCl2+H2O=Sn(OH)Cl↓+HCl
水解後的溶液呈乳白色渾濁,不易被吸附到塑膠表面,也就使活化液中銀的還原成問題而使活化不足,在生產中帶入大量的水使溶液的PH值上升也會出現同樣結果。
對硝酸銀溶液的配製,一定要用蒸餾水,否則,自來水中的Cl-會使硝酸銀消耗:
Ag++ Cl-=AgCl↓
加入的氨水量不宜過多,否則,也會因絡合能力增強而影Ag的還原,同時,生產中敏化後的製品一定要經過認真清洗並在蒸餾水中清洗後,方可進行活化過程。
對於膠體鈀活化法來說,配製是關鍵,如果配製不當,就會沒有活性或者很快就失去活性。無論用哪種方法,一是計量要準確,再一是反應要完全,為此一定要加溫到60℃並保溫8h左右。最好是放置一定時間再使用,則活性最佳。採用等離子計量法可以配製出活性很高且馬上可使用的活化液,但反應溫度如掌握不好,則會因反應太快而出現金屬漂浮於液面的現象,使活化液很快失效。
在生產過程中,要維護好活化液,絕不可將粗化液等破壞膠體的物質帶入液內,此外,要加蓋保存,以防空氣中的氧將Sn+氧化為Sn4+。
另外,解膠液要經常更換,否則,也會影響膠體鈀活化工藝的活性。
常用方法
活化的方法常用的有分步活化和一步活化法。
(1)分步活化法:分步活化法是使塑膠表面浸潤一層具有還原作用的金屬鹽溶液(敏化),通常是氯化亞錫(SnCl2·2H2O),然後再在貴金屬鹽的溶液里還原出催化中心(活化),通常是硝酸銀溶液,也有氯化鈀溶液。
其工藝規範如下。
敏化液:SnCl2·2H2O
10g/L
HCl
40mL/L
錫條
1根
溫度
室溫
時間
5-15 min
活化:①AgNO3
1-3g/L
NH4OH
加至溶液透明
溫度
室溫
時間
5-15 min
②PdCl2
0.5-1g/L
HCl
20-30mL/L
注意硝酸銀要用蒸餾水配製,且進入活化前要用蒸餾水清洗。
(2)一次活化法:一步活化法是使催化金屬還原出來並形成膠體,一次浸潤在塑膠表面,經解膠後即有活性,常用的是膠體鈀法,工藝規範如下。
PdCl2
1g/L
HCl
300mL/L
SnCl2·2H2O
38g/L
溫度
室溫
時間
5-10min
解膠:HCl
80-120mL/L
溫度
室溫
時間
3-5min
這兩種方法比較起來,第一種活化法材料來源較為廣泛,價格便宜,便溶液的穩定性差,且銀只對化學鍍銅有催化作用,對化學鍍鎳則無能為力。採用鈀活化的方法價格較貴,但溶液穩定性好,且對化學鍍銅及化學鍍鎳均有很好的催化效果,所以鍍層的附著力強,產品合格率高 ,質量可靠。
但是在實際生產中,無論採用哪種活化方法都會遇到活化不好的情況,這是什麼原因呢?實踐經驗表明:除了粗化不夠以外,大多數是由於活化液配製不當或者操作不仔細、溶液維護不好造成的。
對於採用氯化亞錫敏化、硝酸銀活化的方法來說,配製敏化液時,應先放鹽酸於少量水中,再加入氯化亞錫使之溶解,最後稀釋到規定的體積,不可顛倒次序,否則,容易因氯化亞錫的水解而使配製失敗。即
SnCl2+ H2O=Sn(OH)Cl↓+ HCl
水解後的溶液呈乳白色渾濁,不易被吸附到塑膠表面,也就使活化液中銀的還原成問題而使活化不足,在生產中帶入大量的水使溶液的PH值上升也會出現同樣結果。
對硝酸銀溶液的配製,一定要用蒸餾水,否則,自來水中的Cl會使硝酸銀消耗:
Ag++ Cl-= AgCl↓
加入的氨水量不宜過多,否則,也會因絡合能力增強而影Ag的還原,同時,生產中敏化後的製品一定要經過認真清洗 並在蒸餾水中清洗後,方可進行活化過程。
對於膠體鈀活化法來說,配製是關鍵,如果配製不當,就會沒有活性或者很快就失去活性。無論用哪種方法,一是計量要準確,再一是反應要完全,為此一定要加溫到60℃並保溫8h左右。最好是放置一定時間再使用,則活性最佳。採用等離子計量法可以配製出活性很高且馬上可使用的活化液,但反應溫度如掌握不好,則會因反應太快而出現金屬漂浮於液面的現象,使活化液很快失效。
在生產過程中,要維護好活化液,絕不可將粗化液等破壞膠體的物質帶入液內,此外,要加蓋保存,以防空氣中的氧將Sn+氧化為Sn4+。
另外,解膠液要經常更換,否則,也會影響膠體鈀活化工藝的活性。