簡介
 分子軌道
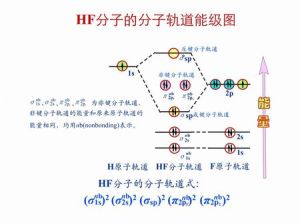
分子軌道原子A及B相互作用,即可形成分子A-B中的兩個分子軌道,其中一個分子軌道能量比原來的軌道要低,叫分子的成鍵軌道;而另一個則比原來要高,叫反鍵軌道。例如,兩個H原子相互作用形成H2分子時,其分子軌道能級上的電子排列情況可用線性組合圖來表示,其上反鍵軌道是空著的。
分子軌道詳解
分子運動描述
分子當中的電子在遍及整個分子範圍內運動,每一個電子的運動狀態都可以用一個分子波函式(或者稱為分子軌道)Ψ來描述。|Ψ|^2表示了電子在空間各處出現的幾率密度。
軌跡原則
原子軌道在組成分子軌道時候,必須滿足下面三條原則才能有效的組成分子軌道。
(1)對稱性匹配原則:兩個原子軌道的對稱性匹配時候它們才能夠組成分子軌道。那么什麼樣子的原子軌道才是對稱性匹配呢?可將兩個原子軌道的角度分布圖進行兩種對稱性操作,即鏇轉和反映操作,“鏇轉”是繞鍵軸(以x軸為鍵軸)鏇轉180度,“反映”是包含鍵軸的某一個平面(xy或者xz)進行反映,即是照鏡子。
若操作以後它們的空間位置,形狀以及波瓣符號均沒有發生改變稱為鏇轉或者反應操作對稱,若有改變稱為反對稱。兩個原子軌道“鏇轉”“反映”兩種對稱性操作均為對稱或者反對稱就稱為兩者“對稱性匹配”。
s和Px原子軌道軌道對於鏇轉以及反應兩個操作均為對稱;Px以及Pz原子軌道對於鏇轉以及反映兩個操作均是反對稱,所以它們都是屬於對稱性匹配,可以組成分子軌道,同理我們還可以得到Py與Py,Pz與Pz原子軌道也是對稱性匹配。
(2)能量近似原則:當參與組成分子軌道的原子軌道之間能量相差太大時候,不能有效的組成分子軌道。原子軌道之間的能量相差越小,組成的分子軌道成鍵能力越強,稱為“能量近似原則”。
(3)最大重疊原則:原子軌道發生重疊時,在可能的範圍內重疊程度越大,形成的成鍵軌道能量下降就越多,成鍵效果就越強,即形成的化學鍵越牢固,這就叫最大重疊原則。例如兩個原子軌道各沿x軸方向相互接近時,由於Py和Px軌道沒有重疊區域,所以不能組成分子軌道;s與s以及Px與Px之間有最大重疊區域,可以組成分子軌道;而s和Px軌道之間只要能量相近也可以組成分子軌道。
分子形成原則
當形成了分子時,原來處於分子的各個原子軌道上的電子將按照泡利不相容原理,能量最低原理,Hund規則這三個原則進入分子軌道。這點和電子填充原子軌道規則完全相同。
分子軌道類型
在價鍵理論當中共價鍵可以分為σ和π鍵。在分子軌道當中我們如何區別它們呢?在氫分子離子形成過程當中我們看到了由兩個1s軌道形成了一個成鍵的σ1s軌道(形狀像橄欖)和另一個反鍵σ1s*(形狀像兩個雞蛋)。凡是分子軌道對稱軸形成圓柱形對稱的叫做“σ軌道”。在成鍵δ軌道上的電子稱為“成鍵σ電子”,它們使得分子穩定化;在反鍵δ*軌道上的電子稱為“反鍵σ電子”,它們使得分子有解離的傾向。由成鍵σ電子構成的共價鍵稱為δ鍵。同樣,我們可以用參加組合的原子軌道圖形,按照一定的重疊方式定性的繪出其他的分子軌道。比如沿著x軸靠近則兩個px軌道將“頭碰頭”的組成兩個σ型分子軌道,如果是py和py,pz和pz就是“肩並肩”的組合稱為另一種形狀的分子軌道,稱為π軌道
它們有一個通過鍵軸與紙面垂直的對稱平面,好像兩個長型的冬瓜,分別置於界面的上下。成鍵π軌道上的電子叫做成鍵π電子,它們使得分子穩定。圖下部反鍵π2p*軌道,它們能量較高,好像四個雞蛋分別置於截面上下。反鍵π軌道上的電子叫做“反鍵π電子”,它們有使得分子解離的傾向。由成鍵π電子構成的共價鍵稱為“π鍵”
由兩個p原子軌道形成的π鍵稱為p-pπ鍵。除此之外,p軌道還可以和對稱性的d軌道形成p-dπ鍵,例如px-dxz。相同對稱性的d軌道之間還能形成d-dπ鍵,例如dzx-dzx。
我們可以看出,無論是δ型軌道還是π軌道,成鍵軌道中的都是電子云在兩核之間的密度比較大,因此有助於兩個原子的組合。在反鍵軌道中,電子云遠離兩核中間區域偏向於兩核的外側,從而使得兩個原子的分離。
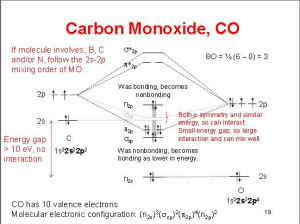
鍵級
鍵級
分子的鍵級等於成鍵電子數減反鍵電子數再除以二。鍵級越大,鍵越穩定,鍵級為0的分子只有稀有氣體。