簡介
定義
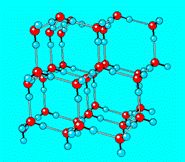
 冰
冰分子間通過分子間作用力(包括范德華力和氫鍵)構成的晶體
性質
1.分子晶體是由分子組成,可以是極性分子,也可以是非極性分子。
2.分子間的作用力很弱,分子晶體具有較低的熔點、沸點,硬度小、易揮發,許多物質在常溫下呈氣態或液態。例如O2、CO2是氣體,乙醇、冰醋酸是液體。同類型分子的晶體,其熔、沸點隨分子量的增加而升高。例如鹵素單質的熔、沸點按F2、Cl2、Br2、I2順序遞增;非金屬元素的氫化物,按周期系同主族由上而下熔沸點升高;有機物的同系物隨碳原子數的增加,熔沸點升高。但HF、H2O、NH3、CH3CH2OH等分子間,除存在范德華力外,還有氫鍵的作用力,它們的熔沸點較高。
3.在固態和熔融狀態時都不導電。
4.其溶解性遵守“相似相溶”原理。極性分子易溶於極性溶劑,非極性分子易溶於非極性的
有機溶劑,例如NH3、HCl極易溶於水,難溶於CCl4和苯;而Br2、I2難溶於水,易溶於CCl4、苯等有機溶劑。根據此性質,可用CCl4、苯等溶劑將Br2和I2從它們的水溶液中萃取、分離出來。
典型代表
①所有非金屬氫化物。
②大部分非金屬單質,如:稀有氣體、鹵素(X2)、氧氣、硫(S8)、氮(N2)、白磷(P4)、C60等(金剛石,和單晶矽等是原子晶體)
③部分非金屬氧化物,如:CO2、SO2、SO3、P4O6、P4O10等(如SiO2是原子晶體)
④幾乎所有的酸
⑤絕大多數有機化合物,如:苯、乙酸、乙醇、葡萄糖等
⑥所有常溫下呈氣態的物質、常溫下呈液態的物質(除汞外)、易揮發的固態物質
相關信息
熔沸點規律
分子間作用力越強,熔沸點越高
①組成和結構相似的分子晶體,一般相對分子質量越大,分子間作用力越強,熔沸點越高。例如:元素周期表中第ⅦA族的元素單質其熔沸點變化規律為:At2>I2 > Br2 > Cl2>F2 。
②若分子間有氫鍵,則分子間作用力比結構相似的同類晶體大,故熔沸點較高。例如:HF > HI > HBr > HCl。
H2O> H2Se> H2S。 NH3> PH3
③組成和結構不相似的物質,分子極性越大,其熔沸點越高,例如:CO>N2
④在有機物的同分異構體中,一般來說,支鏈越多,熔沸點越低,例如:正戊烷>異戊烷>新戊烷
⑤互為同分異構體的芳香烴及其衍生物中,熔沸點順序為:鄰位化合物>間位化合物>對位化合物
結構特徵
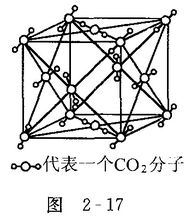 乾冰
乾冰緊密堆積方式
對比
乾冰:范德華力 1個分子周圍緊鄰12個分子
冰:范德華力、氫鍵 1個分子周圍緊鄰4個分子
外觀:兩者相似 硬度:相似(小)熔點:乾冰比冰小 密度:乾冰比冰大
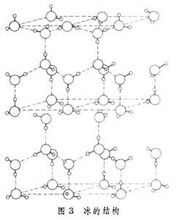 冰
冰