發展歷史
 ECMO培訓
ECMO培訓原理
ECMO是走出心臟手術室的體外循環技術。其原理是將體內的靜脈血引出體外,經過特殊材質人工心肺旁路氧合後注入病人動脈或靜脈系統,起到部分心肺替代作用,維持人體臟器組織氧合血供。ECMO的基本結構:血管內插管、連線管、動力泵(人工心臟)、氧合器(人工肺)、供氧管、監測系統。臨床上常將可拋棄部分組成套包,不可拋棄部分綁定存放,並設計為可移動,提高應急能力。
氧合器(人工肺)其功能是將非氧合血氧合成氧合血,又叫人工肺。ECMO氧合器有矽膠膜型與中空纖維型兩種。矽膠膜型膜肺相容性好,少有血漿滲漏,血液成分破壞小,適合長時間輔助。例如支持心肺功能等待移植、感染所致呼吸功能衰竭。其缺點是排氣困難,價格昂貴。中空纖維型膜肺易排氣,2-3日可見血漿滲漏,血液成分破壞相對大,但由於安裝簡便仍首選為急救套包。如需要,穩定病情後可於一至兩日內更換合適的氧合器。
動力泵(人工心臟)作用是形成動力驅使血液向管道的一方流動,類似心臟的功能。臨床上主要有兩種類型的動力泵:滾軸泵、離心泵。由於滾軸泵不易移動,管理困難。在急救專業首選離心泵作為動力泵。其優勢是安裝移動方便,管理方便,血液破壞小;在合理的負壓範圍內有抽吸作用,可解決某些原因造成的低流量問題;新一代的離心泵對小兒低流量也易操控。
肝素塗抹表面(HCS)技術在管路內壁結合肝素,肝素保留抗凝活性,這就是肝素塗抹表面(HCS)技術。目前常用的有Carmeda塗抹。HCS技術的成功對ECMO技術有強大的促進作用。使用HCS技術可以使血液在低ACT水平不在管路產生血栓;HCS技術可減少肝素用量、減少炎症反應、保護血小板及凝血因子。因此HCS可減少ECMO併發症延長支持時間。
區別
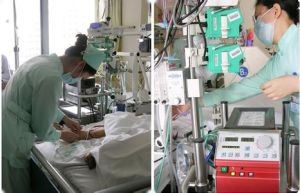 ECMO套用
ECMO套用分類
主要分為兩種方式:V-V轉流與V-A轉流
V-V轉流
經靜脈將靜脈血引出經氧合器氧合併排除二氧化碳後泵入另一靜脈。通常選擇股靜脈引出,頸內靜脈泵入,也可根據病人情況選擇雙側股靜脈。原理是將靜脈血在流經肺之前已部分氣體交換,彌補肺功能的不足。V-V轉流適合單純肺功能受損,無心臟停跳危險 的病例。可在支持下降低呼吸機參數至氧濃度《60%、氣道壓《40cmH2O,從而阻斷為維持氧合而進行的傷害性治療。需要強調V-V轉流是只可部分代替肺功能,因為只有一部分血液被提前氧合,並且管道存在重複循環現象。重複循環現象是指部分血液經過ECMO管路泵入靜脈後又被吸入ECMO管路,重複氧合。
V-A轉流
經靜脈將靜脈血引出經氧合器氧合併排除二氧化碳後泵入動脈。成人通常選擇股動靜脈;新生兒及幼兒由於股動靜脈偏細選擇頸動靜脈;也可開胸手術動靜脈置管。V-A轉流是可同時支持心肺功能的連線方式。V-A轉流適合心功能衰竭、肺功能嚴重衰竭並有心臟停跳可能的病例。由於V-A轉流ECMO管路是與心肺並聯的管路,運轉過程會增加心臟後負荷,同時流經肺的血量減少。長時間運行可出現肺水腫甚至粉紅泡沫痰。這也許就是ECMO技術早期對心臟支持效果不如肺支持效果的原因。當心臟完全停止跳動,V-A模式下心肺血液滯留,容易產生血栓而導致不可逆損害。如果超聲診斷下心臟完全停止跳動>3小時則應立即開胸手術置管轉換成A-A-A模式。兩條插管分別從左、右心房引出經氧合器氧合併排除二氧化碳後泵入動脈。這樣可防止心肺內血栓形成並防止肺水腫發生。
ECMO方式的選擇是要參照病因、病情,靈活選擇。總體來說V-V轉流方法為肺替代的方式,V-A轉流方法為心肺聯合替代的方式。心臟功能衰竭及心肺衰竭病例選V-A;肺功能衰竭選用V-V轉流方法;長時間心跳停止選A-A-A模式。而在病情的變化過程中還可能不斷更改轉流方式。例如在心肺功能衰竭急救過程中選擇了V-A轉流方法,經過治療心功能恢復而肺還需要時間恢復。為了肺功能的快速恢復,轉為V-V模式。不合理的模式選擇則可能促進原發症的進展,降低成功率;正確的模式選擇可對原發症起積極作用,提高成功率。
適應症
ECMO適應症因其強大的心肺替代功能並且操作簡單而非常廣泛。由於ECMO的出現使許多危重症的搶救成功率明顯上升,如ARDS。更令人振奮的是使許多令醫生束手無策的難題有了新的有效解決方法,如心跳呼吸驟停。心跳驟停 ECMO
ECMO呼吸功能衰竭3、急性嚴重呼吸功能衰竭。呼吸功能衰竭是ECMO支持實施最早成功率很高的病種。常見有感染、火災氣體吸入、刺激性氣體吸入、肺挫傷。大多數不用類似於搶救呼吸驟停那樣十萬火急,但仍要爭分奪秒。因為大多數嚴重呼吸功能衰竭病例隨時有心跳驟停的可能。一旦出現心跳驟停或其他器官損害則勢必影響愈後。治療原則還是儘快建立穩定的生命支持,縮短器官缺氧時間。呼吸功能衰竭需要支持時間長,一般選擇V-V轉流,氧合器首選矽膠膜式氧合器。對於肺挫傷首選V-A轉流方法,可減少肺血流,同時可應對可能發生的肺出血。呼吸機治療的參數可在ECMO支持下,調至氧濃度《60%、氣道壓《40cmH2O的安全範圍內。有學者提出用低氣道壓將肺膨脹供氧,排除二氧化碳由人工膜肺完成。
呼吸循環功能疾患4、各種嚴重威脅呼吸循環功能的疾患、酸鹼電解質重度失衡、重症哮喘、溺水、凍傷、外傷、感染。這些是常見的ECMO治療適應症。有的雖然心肺功能尚好,但心肺功能隨時可受原發病影響。可導致功能下降甚至喪失。出於保障可預見性地實施ECMO支持,或準備隨時實施。
對於一些心肺功能沒有恢復可能的病例,仍能通過日益強大的移植技術來脫離ECMO達到康復。這就使一些被認為是禁忌症的疾患仍可延伸使用ECMO技術,並與移植技術結合形成一個理想的救治過程,甚至促進了移植技術的發展。這也很容易理解並形成了一個趨勢——人工臟器在移植技術中的重要地位。目前已有一些醫療中心在作這方面的探索,並取得了一定成績。而這一切工作的基礎就是其他器官的保護,避免多個器官損害是成功的關鍵。
臨床套用
新生兒肺疾病 ECMO
ECMO急性呼吸衰竭
ARDS和急性肺損傷用於急性呼吸功能衰竭的替代治療是研製ECMO的初衷。一般認為,誤吸、創傷、嚴重肺部感染、膿毒血症等直接或間接造成肺損傷,繼而引起的呼吸衰竭和ARDS是ECMO的適應症,特別適用於小兒或成人的急性肺損傷。但作為一種操作複雜、管理繁瑣、費用昂貴的治療手段,臨床上通常在常規呼吸支持和輔助治療無效後才考慮使用ECMO。臨床病例報導顯示採用傳統呼吸支持治療為主的綜合治療,呼吸衰竭患者的生存率約為18%~44%,但同期相同嚴重程度的呼衰患者經ECMO和保護性機械通氣等治療措施,生存率可達66%。因此,在傳統方法治療過程如病情繼續進展或伴心血管功能不穩定的呼衰患者,為保持良好的氣體交換、避免通氣過度和氣道高壓,ECMO也不失為一種臨時挽救生命的手段。目前對何時該啟用ECMO尚無統一標準,成人ARDS的一個入選指標是吸入純氧2小時PaO2<50mmHg。但上述指標的合理性和嚴謹性仍需進一步評估和統一。由於ECMO只是暫時的替代措施,因此不適用於不可逆的心肺腦疾病和預後不良的患者。相對禁忌症則包括老年、免疫抑制、腦外傷、左心衰、肝素誘導血小板減少症等。
心臟手術由於VA-ECMO的血流灌注可達心輸出量的75%,因此有人將ECMO嘗試用於CPB脫機困難的心臟手術病人。治療期間必須保證正常肺通氣以防肺不張,並注意維持正常的血CO2和O2分壓。至於在先天性心臟病新生兒心臟手術前使用ECMO,尚存在爭議。
肺梗塞或氣道梗阻對急性肺梗塞和氣道梗阻的患者,快速建立ECMO是一種有效的搶救措施。
心肺移植手術ECMO不僅可為晚期心肺功能衰竭而等待移植手術的患者爭取足夠的時間,也可改善全身狀況,對預後有利。ECMO還為順利度過手術和術後恢復期保駕護航。肺移植術後的再灌注水腫和呼吸衰竭是臨床治療的難點,因此有人在肺移植術中建立ECMO代替CPB,並將ECMO支持時間延長到術後,這對危重病人的管理和肺功能的恢復非常有利,尤其是肺動脈高壓行單肺移植者。在心臟移植術後,心肌頓抑常導致頑固性的心功能衰竭,而ECMO支持則為心肌頓抑的恢復創造條件。雖然主動脈內球囊反搏更常用於臨床,但它只針對左心繫統,不能對嚴重心衰病人提供足夠的循環支持,且在股動脈較細的小兒患者使用受限。在這些情況下,ECMO能代替球囊反搏或兩者聯合治療。
其他ECMO在臨床難於處理的代謝性酸中毒、心肌炎、頑固性休克、無心跳供體的臟器保護等方面也能發揮其特殊的治療價值。並發或並存急性腎功能衰竭、肝功能衰竭時,需要血液透析治療,可將血透機或其他支持裝置連線在ECMO迴路上,用於支持多臟器功能。
治療併發症
ECMO的併發症主要包括機械原因和生理原因兩大類。前者如迴路血栓堵塞或脫落、氧合器功能不良、機械泵或加熱器故障、置管和拔管相關併發症等。一旦發生上述併發症,應迅速讓機體從ECMO上脫離,並恢復治療前的機械通氣,同時處理相應的迴路問題。生理原因主要跟ECMO擾亂了凝血功能和動脈搏動灌注方式有關,主要包括以下幾方面。
中樞神經系統
ECMO無脈搏轉流和右頸動脈的結紮改變了正常的血液循環方式,有可能導致右腦損傷和聽力損害,ECMO期間保持正常的頭位以利於良好的顱內血供對預防中樞神經系統併發症十分重要。為避免右頸內靜脈血液淤滯,有人建議經頸內靜脈向腦端置管,充分引流顱內血液從而減輕腦淤血。此外,鎮靜劑的套用可減少ECMO期間躁動和癲癇的發生。
血液系統
主要是出血傾向,顱內出血尤其是新生兒腦室出血發生率在14%左右。在不足35周的新生兒套用ECMO,幾乎100%發生腦室出血,因此ECMO禁用於不足36周的新生兒。ECMO轉流期間血小板易粘附於矽膠膜和管道表面,導致血小板的持續破壞和消耗,因而ECMO對血液系統損害最大的是血小板。故ECMO治療期間一般需每天補充濃縮血小板。紅細胞破壞和溶血也容易發生,因而成人有時需補充濃縮紅細胞。肝素化迴路可減少血細胞的破壞,降低出血的發生率,但價格較昂貴。
心血管系統
ECMO期間有時出現心搏出壓和搏出量極度降低的現象,即所謂的心臟暈厥現象,一般持續時間較短暫,具體機理不明,但與死亡率有關。此外,高血壓也是ECMO期間一種危險的併發症,可增加顱內出血的危險,甚至誘發心包填塞。栓塞也是常見併發症,氣栓或者血栓可引起神經系統和外周組織梗塞的相應症狀。
其他
少尿在ECMO早期常見,另外還有感染、水電解質紊亂、酸鹼平衡失調等。