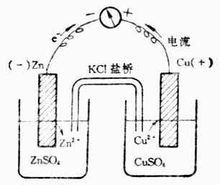
物理套用
判斷氧化還原反應自發進行的方向
電池反應都是自發進行的氧化還原反應。因此電池反應的方向即氧化還原反應自發進行的方向。判斷氧化還原反應進行的方向時,可將反應拆為兩個半反應,求出電極電位。然後根據電位高的為正極起還原反應,電位低的為負極起氧化反應的原則,就可以確定反應自發進行的方向。如果兩個電對的值相差較大(即E),濃度的變化對電位的影響不大,不至於使反應改變方向。因此,當E>0.2V時,即使不處於標準狀態,也可直接用 值的大小確定反應方向。否則,必須考慮濃度和酸度的影響,用能斯特方程式計算出電對的值,用E>0作為判斷確定反應進行的方向,若E>0,正向反應能自發進行;E<0,正向反應不能自發進行,其逆向反應能自發進行。
例1判斷298K時下列反應進行的方向:
Cu(0.00001mol·L) + 2Fe ≒ Cu + 2Fe(1.0mol·L)
解:將上述反應寫成兩個半反應,並查出它們的標準電極電位:
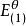 電極電位
電極電位Cu + 2e → Cu
= 0.340V
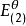 電極電位
電極電位Fe + 2e → Fe
= -0.44V
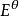 電極電位
電極電位標準電動勢為:
=
-
=0.340V-(-0.44V)=0.780V。
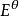 電極電位
電極電位因為
>0.2V,可直接用
值判斷反應進行的方向。
>
,表明Cu是比Fe更強的氧化劑,Fe是比Cu更強的還原劑所以上述反應可自發地向右進行。
為了證明這個結論的正確性,我們可以按非標準態的電池反應計算電動勢。
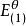 電極電位
電極電位E=
+
lg[Cu]
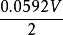 電極電位
電極電位=0.340V +
lg0.00001
=0.340V - 0.148V
=0.192V
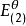 電極電位
電極電位E=
= -0.44V
E=E-E2=0.192V - (-0.44V) = 0.632V
因為E>0,上述反應可自發地向右進行。
例2判斷298K時反應
當[HAsO]=[HAsO]=1mol·L,[I]=1mol·L,在中性和酸性([H]=1mol·L)溶液中反應進行的方向。
解:將上述反應寫成兩個半反應,並查出它們的標準電極電位:
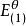 電極電位
電極電位I + 2e≒ 2I
= 0.5355V
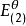 電極電位
電極電位HAsO+ 2H + 2e ≒ HAsO+ 2HO
=0.560V
在中性溶液中,[H]=1.0×10mol·L,
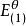 電極電位
電極電位E=
= 0.5355V
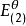 電極電位
電極電位E=
+
lg
=0.560V+0.0592Vlg10
=0.560V-0.414V
=0.146(V)
因為E >E,所以I是比HAsO更強的氧化劑,而HAsO是比I更強的還原劑。因而上述反應能自發地向右進行。即:
HAsO+I+2HO → HAsO+2I+2H
當溶液中氫離子濃度為1mol·L時,
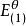 電極電位
電極電位E=
= 0.535V
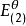 電極電位
電極電位E=
=0.560
因為E
HAsO+2I+2H→HAsO+I+2HO
判斷氧化還原反應進行的程度
氧化還原反應屬可逆反應,同其他可逆反應一樣,在一定條件下也能達到平衡。隨著反應不斷進行,參與反應的各物質濃度不斷改變,其相應的電極電位也在不斷變化。電極電位高的電對的電極電位逐漸降低,電極電位低的電對的電極電位逐漸升高。最後必定達到兩電極電位相等,則原電池的電動勢為零,此時反應達到了平衡,即達到了反應進行的限度。利用能斯特方程式和標準電極電位表可以算出平衡常數,判斷氧化還原反應進行的程度。若平衡常數值很小,表示正向反應趨勢很小,正向反應進行得不完全;若平衡常數值很大,表示正向反應可以充分地進行,甚至可以進行到接近完全。因此平衡常數是判斷反應進行 程度的標誌。
氧化還原K與反應中兩個電對的標準電極電位的關係為:
 電極電位
電極電位=
(1-1)
式中, n—反應中得失電子數;
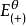 電極電位
電極電位—正反應中作為氧化劑的電對的標準電極電位;
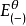 電極電位
電極電位—正反應中作為還原劑的電對的標準電極電位。
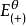 電極電位
電極電位由式(1-1)可見,
與
之差值愈大,K值也愈大,反應進行得也愈完全。
例3計算下列反應在298K時的平衡常數,並判斷此的以應進行的程度。
Ag+ Fe≒ Ag + Fe
解:將上述反應寫成兩個半反應,並查出它們的標準電極電位:
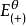 電極電位
電極電位Ag+ e≒ Ag
=+0.7991V
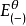 電極電位
電極電位Fe+e ≒ Fe
=+0.771V
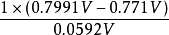 電極電位
電極電位lgk=
=0.4747
K=2.983
此反應平衡常數很小,表明此正反應進行得很不完全。
物理關係式
金屬可以看成是由離子和自由電子組成。
金屬離子以點陳排列,電子在其間運動。對於給定的電極而言,電極電位是一個確定的常量,對於下述電極反應:
aA+bB<=>cC+dD+ne
電極電位可表示為
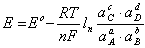 電極電位
電極電位(1.1)
式中
E:電極電位,V;
Eo:標準電極電位,V;
R:氣體常數,8.31441J/(mol·k);
T:絕對溫度,k;
n:參與電極反應的電子數;
F:法拉第常數,96486.7C/mol;
a:參與化學反應各物質的活度。
式(1.1)是電極電位的基本關係式。
單個的電極電位是無法測量的,因為當用導線連線溶液時,又產生了新的溶液-電極界面,形成了新的電極,這時測得的電極電位實際上已不再是單個電極的電位,而是兩個電極的電位差了。同時,只有將欲研究的電極與另一個作為電位參比標準的電極電位組成原電池,通過測量該原電池的電動勢,才能確定所研究的電極的電位。