簡介
金屬中氣體通常指金屬中的氫、氮和氧。這些氣體的分子都是雙原子氣體(H2、N2和O2)。在固態金屬表面,它們能以分子形式產生物理吸附;當氣體同金屬表面的結合力大於氣體分子內部的結合力時產生化學吸附,在金屬表面形成薄層。吸附在金屬表面的氣體分子可以分解成原子從金屬表面擴散入內部。由於氫、氮和氧的原子半徑 rX都很小,分別為0.46、0.71和0.70┱,因此在固態過渡族金屬中,它們占據晶體點陣的間隙位置,和這些金屬形成間隙固溶體。超過固溶極限時,將析出金屬化合物(即氫化物、氮化物和氧化物),彌散於晶粒內或存在於晶界上。同樣,由於原子半徑 rX較金屬原子半徑 rM小( rX/ rM<0.59),氫和氮在形成的金屬化合物中仍占據間隙位置,多數形成結構簡單的間隙相(見合金相)。常見的金屬氧化物則多為化學化合物。當金屬中存在微孔隙時,過飽和氣體也能以氣體分子形態析出到這些微孔隙內。
溶解度
 金屬中氣體
金屬中氣體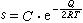 金屬中氣體
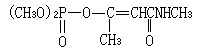
金屬中氣體氣體在液態或固態金屬中的溶解度 s與金屬的溫度及氣體的分壓 p有關。當溫度不變時, s與 p的平方根值成正比:即西韋特(Sievert)定律,式中 k為常數。當氣體分壓固定,溶解度 s與溫度 T的關係可用下式表示:式中 C為常數; Q為氣體的溶解熱; R為氣體常數; T為絕對溫度。
 金屬中氣體
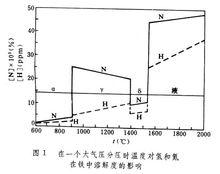
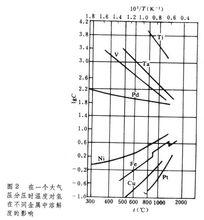
金屬中氣體氫、氮和氧在各種金屬元素中的可溶性見表1。氣體在金屬中的溶解度在相變溫度和熔化時出現突變。圖1反映了氫和氮在固態鐵和液態鐵中溶解度的變化。中R表示元素。氫在鐵、鈷、鎳、銅和錳等金屬中的溶解是吸熱過程,溶解度( C)隨溫度升高而增大;反之,氫在過渡金屬、稀土金屬和釷中的溶解是放熱過程,溶解度隨溫度升高而減少;如圖2所示。 氮只溶於形成氮化物的金屬中,氮與各金屬元素的關係見表2。 許多金屬在熔融狀態能溶解大量氧;大多數金屬在凝固時析出氧化物。由於氧的濃度很低,一般在ppm數量級甚至更低,測定氧的溶解度也比較困難。
 金屬中氣體
金屬中氣體氣體在過渡族金屬中的溶解度隨其電子結構而不同,ⅤB族金屬(V、Nb、Ta)中的氫、氮和氧的溶解度便較高,而ⅥB族金屬(Cr、Mo、W)則甚低,如表3。 這些填隙原子在金屬中的含量超過溶解度時,就會使金屬變脆。通過純化來提高韌性,對 V、Nb、Ta來說,比較容易做到,而對Cr、Mo和W來說就很難。這三種金屬在冶煉和加工工藝上的困難,也與此有關。
影響
 金屬中氣體
金屬中氣體 金屬中氣體
金屬中氣體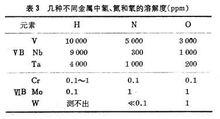 金屬中氣體
金屬中氣體有關氣體對金屬作用的研究可以追溯到18世紀後半葉。一般來說,固溶的氧和氮都能增大金屬的點陣常數,提高強度和硬度,降低塑性和韌性,並使金屬的電阻率增加、磁化率減小。氫、氮和氧降低鈮和鉭的超導臨界溫度。過量的氧在鈮、鉬、鎢和鉭的晶界上析出氧化物,使其斷裂強度下降。氧和氮降低鉬和鎢的再結晶溫度。氧增加鈹的脆性,金屬鈹表面有一層氧化鈹薄膜,使鈹的硬度增高到能劃破玻璃。微量氧使銣的高溫抗腐蝕能力下降。氧能在多種金屬與合金表面和金屬元素作用,生成保護性氧化膜。氮是導致鋼產生藍脆的主要原因。在金屬的熔煉澆注和凝固過程中,氧和氮與金屬反應形成金屬氧化物和氮化物,在金屬凝固後繼續保留在金屬中,形成金屬中非金屬夾雜物,對金屬性能產生重大影響。氧一般不作為有利元素加入金屬內。氮有時被加到鋼中起著合金元素的作用,如鉻錳氮耐熱不鏽鋼中氮代替了鎳鉻不鏽鋼中的鎳。氮在滲氮結構鋼中形成鉻和鋁的氮化物,可提高鋼的耐磨性和抗蝕性。鋼或金屬表面採用離子鍍新工藝鍍上氮化鈦層,可延長材料的使用壽命,金黃色的氮化鈦還可製成仿金裝飾品。
氫在金屬中的作用,見金屬中氫。
溶解氣體金屬
金屬溶解氣體,大多是在熔融狀態中。但是,也有極少數的金屬可以再固態常溫下溶解氣體,以下介紹兩種金屬 。
鈀
先介紹一下鈀的性質,這是一種銀白色金屬。晶體結構:晶胞為面心立方晶胞,每個晶胞
含有4個金屬原子。
 鈀晶體
鈀晶體其化學性質十分穩定。
據試驗,鈀在常溫下可以吸收比他體積大700倍的氫氣,還可以吸收氮氣,氧氣乙烯等常見氣體。
經X射線研究表明,當氫氣溶解到鈀中後,鈀的晶格脹大,當鈀中的氫氣濃度大到某一個程度時,鈀的晶格會轉變為更加疏鬆的一個形式,可見,鈀溶解氣體這一特性與其特有的結構有關。
鉑
鉑應該是一個不陌生的元素,此處不多做介紹。
 此圖為鉑與金的混合物,當中銀白色的為鉑
此圖為鉑與金的混合物,當中銀白色的為鉑晶體結構:等軸晶系,晶胞為面心立方晶胞,每個晶胞含有4個金屬原子。
晶胞參數:
| a | 392.42 pm |
| b | 392.42 pm |
| c | 392.42 pm |
| α | 90° |
| β | 90° |
| γ | 90° |
鉑也可以溶解許多氣體,如氫氣,氧氣。常溫下,鉑對於氫氣的溶解性要比鈀小,但是,粉末狀的鉑對於氧氣的溶解度要比鈀大。
具體套用
由於類似鈀和鉑等金屬具有常溫下溶解氣體的能力,所以經常用於作催化劑。比如在化學工業上在鉑的催化下,液態的油脂可以加氫變為固態;在鉑粉的催化下,常溫時,氫、氧就會爆炸發生化合 。
雖然科學家沒有徹底弄清鈀和鉑的催化原理,但是人們普遍認為由於鉑和鈀溶解了大量的氣體,相當於將氣體壓縮,這樣增加了氣體分子只見碰撞的機率,從而加快了,促進了反應的發生。詳見碰撞理論