phase change heat
指物質在相變化過程中吸收或釋放的熱量,主要有:(1)蒸發熱,由液相變為氣相時的相變熱;(2)熔化熱,由固相變為液相時的相變熱;(3)升華熱,由固相直接變為氣相時的相變熱。在化工中,蒸發熱最常用。
確定相變熱常用的方法有兩種。(1)直接量熱。例如在等壓(壓力等於飽和蒸氣壓)下測定一定量液體蒸發所需的能量,算出蒸發熱。(2)先測量不同溫度下的飽和蒸氣壓;然後用克勞修斯-克拉珀龍方程計算蒸發熱。許多物質的相變熱數據刊在有關手冊中,也可用經驗式計算。其中蒸發熱數據已較完備,經驗式的精度也較高。
計算蒸發熱常用里德爾式:△H=1.093RTb(lnPc-1)/(0.930-Tbr)Tbr=Tb/Tc
式中,△Hr為正常沸點下的蒸發熱;只為摩爾氣體常數;Tbr和Tc分別為正常沸點和臨界溫度,Tb為被測定的溫度;Pc為臨界壓力(kg/cm2)。此式預測誤差不大於2%。計算蒸發熱還常用沃森式:
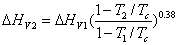 相變熱
相變熱式中下標1和2分別表示兩個不同溫度。此式用於從某一溫度下的蒸發熱計算另一溫度下的蒸發熱。
熔化熱不但取決於溫度,還同固相的晶形有關,因而缺乏通用的計算方法。對於單原子物質,可用下式估算:
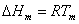 相變熱
相變熱式中,△Hm
為,熔化熱;Tm為正常熔點;及為摩爾氣體常數。
升華熱一般可以看作是熔化熱與蒸發熱之和。
