簡介
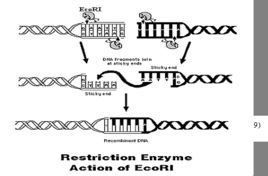
30多年前,當人們在對 噬菌體(細菌病毒)的宿主特異性的限制-修飾現象進行研究時,首次發現了限制性內切酶。細菌可以抵禦新病毒的入侵,而這種"限制"病毒生存的辦法則可歸功於細胞內部可摧毀外源DNA的限制性內切酶。首批被發現的限制性內切酶包括來源於大腸桿菌的EcoR I和EcoR II,以及來源於Heamophilus influenzae的Hind II和Hind III。這些酶可在特定位點切開DNA,將基因切割成小的基因片段。
當限制性 內切酶的套用在上世紀七十年代流傳開來的時候,以NEB為代表的許多公司開始尋找更多的限制性內切酶。除了某些病毒以外,限制性內切酶只在原核生物中被發現。人們正在從數以千計的細菌及古細菌中尋找新的限制性內切酶。而對已測序的原核基因組數據分析表明,限制性內切酶在原核生物中普遍存在,所有自由生存的細菌和古細菌似乎都能編碼限制性內切酶。
限制性內切酶的主要功能是保護細菌不受噬菌體的感染,這一觀點已被人們廣泛接受。它們作為微生物免疫機制的一部分行使其功能。當一個沒有限制性內切酶的細菌被病毒感染時,大部分病毒顆粒都能成功地進行感染。然而一個有限制性內切酶的同種細菌被成功感染的比率顯著下降。出現更多的限制性內切酶將會起到多重保護作用;而一個擁有4到5種各自獨立的限制性內切酶將會使細胞堅不可摧。
上世紀80年代,科學家開始 克隆並表達限制性內切酶。克隆技術由於將限制性內切酶的表達與原有細胞環境分離開來,避免了原細胞中其它內切酶的污染,從而提高了酶的純度。此外,克隆技術提高了限制性內切酶的產量,簡化了純化過程,使得生產成本顯著降低;克隆的基因很容易進行測序分析,表達出的蛋白也能進行X射線結晶分析,這使得我們對於克隆產物更加確定。
核糖核酸酶是一類廣泛存在於動植物體內的核酸水解酶.其作為一種模型蛋白被普遍用於分子生物學研究,主要生理功能是控制細胞內RNA的種類與數量分布,除參與核糖核酸轉錄後的剪下、修飾和降解等過程外,還與某些植物的自交不親和性、器官發生、宿主的防禦機制、控制腫瘤血管生成、殺滅腫瘤細胞及抑制病毒(包括HIV-1)的複製等有關。
限制酶圖
同一DNA用不同的限制酶進行切割,從而獲得各種限制酶的切割位點,由此建立的位點圖譜有助於對DNA的結構進行分析。
限制性核酸內切酶分析技術是病原變異、毒株鑑別、分型及了解基因結構和進行流行病學研究的有效方法,對動物檢疫有很重要的實用意義,尤其對區別進出境動物及動物產品攜帶病毒是疫苗毒還是野毒,以及推論其是本地毒還是外來毒有很重要的意義。
作用及分類
限制性核酸內切酶(以下簡稱限制性酶)是一類識別雙鏈DNA中特定核苷酸序列的DNA水解酶,以內切方式水解DNA,產生5’-P和3’-OH末端。 1952年Luria等及1953年Bertani等研究噬菌體時發現了宿主控制性現象。Arber及其同事用放射性同位素標記證明,噬菌體在新品系中的損害伴隨有其DNA的降解,但宿主自己的DNA並不降解,據此他們提出了限制 - 修飾酶假說。對於一個宿主細胞,限制性酶及 DNA甲基化酶是其細胞中的一對酶,它們對DNA底物有相同的識別順序,但有相反的生物功能,限制性酶的功能是在DNA分子內部拆卸水解,甲基化酶是修飾,DNA分子經修飾後,就可逃避限制性酶的識別,而甲基化酶只修飾宿主自身的DNA,從而避免了限制性酶對自身DNA的破壞。
限制性酶主要分為三種類型:Ⅰ型限制酶為複合功能酶,具有限制-修飾兩種功能,但在 DNA鏈上沒有固定的切割位點,一般在離切割位點1kb到幾kb的地方隨機切割,不產生特異性片段。Ⅲ型酶與Ⅰ型酶基本相似,不同的是Ⅲ型酶有特異性的切割位點,但這兩類酶對 DNA酶切分析的意義不大,通常所說的限制性內切酶是指Ⅱ型酶,它能夠識別與切割DNA鏈上的特定的核苷酸順序,產生特異性的DNA片段。
2.識別序列及消化產物的末端結構 限制性酶的識別序列,大部分具有雙軸對稱性結構或稱迴文序列,如EcoRI的識別序列為:
GAA
TTC
橫軸
CTT
AAG
縱軸
將縱軸一側的序列以橫軸為中心鏇轉180°,則縱軸兩側的序列相互對稱,這種結構又稱為雙重對稱結構。大部分酶的識別序列長度為4-6個核苷酸。4核苷酸序列在DNA鏈中出現頻率高,對一隨機排列的DNA分子來說,理論值為1/44,因此4核苷酸識別序列的限制性酶在DNA鏈上切點多,產生片段的數目多,長度短,顯示出酶的特異性較低。對於5和6核苷酸識別序列的酶,出現頻率分別為1/45和1/46 ,因此,6核苷酸序列在DNA中出現頻率低,酶的特異性強,而8核苷酸識別位點在DNA鏈中出現機率更低(1/48 ),特導性更強,可提供更長的DNA片段。一部分限制性酶具有非典型的雙軸對稱性序列,其回文識別序列被個或幾個其他核苷酸所間隔,如BglⅠ,這種酶的特異性比識別長度相同的典型迴文序列的酶略高。另外有些限制性酶(約10種,如BbVⅠ等),其識別序列不表現為迴文結構,它們降解雙鏈DNA時,酶切點大部分不在識別序列內,而是與識別序列相距5至13個核苷酸殘基不等。
限制性酶切片段的末端結構:限制性酶不但有特定的識別序列,並且任何一種酶切割 DNA鏈時,總是水解核苷酸3’和5’-磷酸二酯鍵的3’位磷酸酯鍵,使產物的5’端帶磷酸單酯基團,而3’末端則為游離羥基。因此某一種酶的全部產物的末端具有相同的結構。根據切點序列的結構特點,產物的末端可分為粘性末端和平末端兩類。粘性末端指酶切後DNA片段末端帶有1-4個核苷酸殘基的單鏈結構,而片段兩端突出的單鏈具有互補性,突出的單鏈因部位的不同,又可分為5’-與3’-粘性末端兩種,突出的單鏈帶5’磷酸單酯的稱5’-粘性末端,而突出的單鏈含3’-羥基則稱3’-粘性末端。平末端指酶切後,片段為齊頭末端結構。在DNA體外重組時,粘性末端是DNA連線酶的有效底物,有很高的連線效率。