簡介
1976年6月日本發生因食用紫貽貝Mytilus edulisLinnaeus而引起的集體食物中毒事件,因中毒症狀以腹瀉為主,故稱腹瀉性貝毒。鑒於其對雙殼貝類養殖業的嚴重威脅,日本學者紛紛對其毒素進行研究。從那時起,腹瀉性貝類毒素(DSP)所引起的食物中毒在世界各地不斷有報導。1997年6月,在英國49人因食用貝類而導致持續8h之久的急性噁心、嘔吐、腹瀉和腹痛等症狀。研究者們對其食用貝類樣品用小鼠生物鑑定,發現其作用因子為DSP毒素。採用高效液相色譜(HPLC)分離和X線量檢測進一步分析證實該毒素主要成分為岡田軟海綿酸(OkadaicAcid,OA)。
DSP在海洋生物毒素中,尤其是在貝類毒素中占據重要地位,已成為影響貝類養殖業和食品衛生的一個嚴重問題。已經確認DSP的成分有3個組分:第1組分為岡田軟海綿酸(OA)及其衍生物鰭藻毒素-1(DTXl)和鰭藻毒素-3(DTX3),第2組分為扇貝毒素-l(PTXl)、扇貝毒素-2(PTX2)、扇貝毒素-3(PTX3)、扇貝毒素-6(PTX6),第3組為蝦夷扇貝毒素(YTX)及其衍生物45-OHYTX。至今至少有12種成分,其中9種的結構已明確,與腹瀉有關的主要是第1組分。
1981年Tachibana等從日本產軟海綿屬的岡田軟海綿HalichondriaokadailKadota及美國佛羅里達州產的近緣種Halichondria melanodocia發現了具有特殊構造的聚醚(polyether)化合物。這就是岡田軟海綿酸(Okadaic Acid,OA),它是一類長鏈脂肪酸,屬於聚醚類毒素,由共生於岡田軟海綿(halichondria okadai)和隱瓜海綿(H.melanodocia)中的利馬原甲藻(P.lima)所產生。Tachibana首次從岡田軟海綿(Halichondriaokadai)和隱海綿(H.melanodocia)中分離到OA,此後不久,Murakami等證實OA實際上是由與上述兩種海綿共生的一種微藻—利馬原甲藻(Prorocentrumlima)產生的,海綿通過濾食此種微藻而將OA濃集於體內。後來的研究均證實OA是海洋藻類的代謝產物,產生OA毒素的藻類在全球主要海域中幾乎都有分布,主要甲藻有漸尖鰭藻(Dinophysis acuminata)、具尾鰭藻(Dinophysis caudata)、倒卵形鰭藻(Dinophysis fortii)、利瑪原甲藻(Pyrophacus/Protoperidiniumlima)、帽狀禿頂藻(Dinophysis mitra)和三角鰭藻(Dinophysis tripos)等。在貝類、魚類和其他動物的濾食或攝食過程中,海水中產生OA的藻類作為食物轉移到它們的胃或食道中,經胃和腸消化、吸收並導致OA在貝體內的積累。積累這類毒素的貝類有日本櫛孔扇貝(Chlamysnipponesisakazara)、凹線蛤蜊(Mactra sulcatria)、紫貽貝(Mytilus cdulis)、牡蠣(Ostrea sp.)和錦蛤(Tapes japonica)等。
當有毒微藻被雙殼貝類濾食後,OA毒素會在貝類消化腺內累積。食用染毒貝類後,患者會出現腹瀉、嘔吐等急性中毒症狀。OA的LD50(小鼠腹腔注射)為192μg/kg體重,LD50(小鼠靜脈注射)為166μg/kg體重。儘管尚未見人OA中毒致死的報導,但OA是分布最廣,發病率最高的海洋毒素之一,在隨血液的循環轉運和代謝過程中,還會對體內多種臟器造成損傷,且中毒後無特效藥救治。OA雖然沒有顯著的急性毒性效應,但作為蛋白磷酸酶PP1和PP2A的烈性抑制劑,能抑制蛋白磷酸酶活性而導致蛋白質過磷酸化,從而對生物的多種生理功能造成影響,同時,由於對磷酸酶的抑制,可能影響到DNA複製和修復過程中的酶活性,從而帶來致畸效應。OA被公認為是一種潛在的腫瘤促進劑甚至是原始致癌劑。其長期毒性效應對貝類養殖業的發展和公眾健康構成了嚴重威脅。
理化性質
化學性質及結構
 OA紅外光譜
OA紅外光譜岡田軟海綿酸因其來源為海綿Hailchondriaodadail和H.melanodocia,故命名為okada-ic acid。相繼的研究發現,它並不是由貝類、海綿自身合成,而是由與海綿共生的渦鞭毛藻所產生。海洋中其它渦鞭毛植物如P.maculosum,P.concavum,P.hoffmanianum等也產生OA毒素。免疫定位實驗表明,OA位於渦鞭毛植物外周的葉綠體和溶酶體裡面,可能與膜磷脂相聯。貝類通過濾食作用將藻毒素濃縮積累,經食物鏈傳遞,影響和危害人體健康。雙殼貝毒化的季節因地域、年次而有所差異,但通常發生在六、七月份。其實日本民間早有傳說,日本泡桐(Paulownia)開花季節殼貝類有毒。因毒化而造成危害的雙殼貝類在日本主要有紫貽貝、貽貝、扇貝及黑淺蛤,在歐洲幾乎全是紫貽貝。
 OA標準品螢光光譜
OA標準品螢光光譜OA屬於聚醚類海洋生物毒素,是C38多環聚醚類脂肪酸的衍生物,分子式為C44H68O13,基本骨架幾乎全部由乙酸構成。C-1位羧酸基團經化學修飾可顯著降低毒素對磷酸酯酶活性的抑制作用,C-1位接甲醚基的OA完全失去抑制作用。對OA及其17種衍生物的構象關係研究表明,C-2、C-7、C-24和C-27位羧基和4個羥基是影響磷酸酯酶活性的關鍵基團,4個羧基位氧原子甲基化顯著降低OA的毒性效應。與OA結構相近的鰭藻毒素(Dinophysistoxin,DTX)DTX-1、DTX-2、DTX-3 也構成DSP 有毒成份。無毒性的DTX-4是OA生物合成的前體,在其無活性部位二元醇酯鍵處斷開便得到有毒性的OA。
OA是一種脂溶性化合物,無色晶體,不溶於水,但可溶於甲醇、乙醇、氯仿和乙醚等有機溶劑,不吸收紫外線,熔點為134℃。OA有很強的穩定性,對一般加工處理,如冷凍、取內臟、臭氧化及熱處理無明顯影響。有研究稱電離輻射對DSP 的降解有一定的效果,但尚不能確定劑量和方式對降解程度的影響。
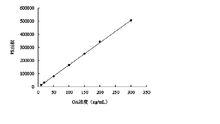 OA標準曲線
OA標準曲線OA是基本骨架幾乎全部由乙酸分子構成。Holmes等研究表明,C-1位羧酸基團經化學修飾可顯著降低這種毒素對磷酸酯酶活性的抑制能力,而C-1位接甲醚基的OA則完全失去抑制磷酸酯酶活性作用。Nishiwaki等對OA結構修飾的研究表明,C-2、C-7、C-24和C-27位的羥基基團影響磷酸酯酶活性,C-2、C-7、C-24和C-27位氧原子甲基化明顯降低OA的毒性效應。與OA結構相近的輪狀鰭藻毒素(Dinophysistoxin,DTX)DTX-1、DTX-2T DTX-3也構成DSP有毒成份。無毒性的DTX-4是OA生物合成的前體,在其無活性部位二元醇酯鍵處斷開便得到有毒性的OA。另外,Traore等對受污染貝類進行的研究發現,遠遠低於可接受濃度範圍內的金屬離子(Al3+、Cu2+、Pb2+、Hg2+、Cd2+)能協同增強培養細胞中低濃度OA的細胞毒性。這一作用的機制還不很明確,可能與OA的特殊結構有關。
食用標準
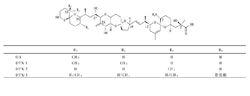 OA及其同系物結構式
OA及其同系物結構式有關OA等DSP毒素的食用標準,各國所建議食用標準的安全濃度不同,日本規定扇貝中腸腺OA為2.5μg/g,紫貽貝中腸腺1.5μg/g,澳大利亞規定100g可食部分含OA低於25μg,1g中腸腺含OA低於2μg,歐洲規定1g可食部分允許含0.2-0.6μgOA等價物。法國、西班牙、丹麥和紐西蘭用小鼠方法表示為“有毒素檢出”,加拿大、英國等為16μg/100g軟組織,荷蘭定為0.12-0.14μg/g消化腺。中國,1993年,中國原進出口商品檢驗局出台了《出口貝類腹瀉性貝類毒素的檢驗方法》(SN0294),明確以小鼠法作為貝類產品中DSP毒素的標準檢驗方法。此後,由中國國家質量監督檢驗檢疫總局2001-08-06發布,於2001-10-01實施的國家標準《無公害食品水產品中有毒有害物質限量》(GB18406.4-2001)中規定水產品中DSP限量標準為60μg/100g可食部分,而農業部2006-01-26發布,於2006-04-01實施的行業標準《無公害食品水產品中有毒有害物質限量》(NY5073-2006)中規定無公害水產品DSP不得檢出。2008年,衛生部出台國家標準《貝類中腹瀉性貝類毒素的測定》(GB/T5009.212),沿用了小鼠法作為標準檢驗方法,該方法是在SN0294基礎上的進一步完善。
毒理學
毒性及分布
雖尚未見人類因OA中毒而致死的報導,但在所有海洋毒素中,它的分布範圍最廣,發病率最高,幾乎所有已開發國家都在本國海域發現和檢出本類毒素,最嚴重的是日本,自從1976年發生首例164人中毒的事件以來,到1982年的幾年中就有1300人次發生DSP中毒。中國1996和1997年在深圳的一項調查顯示,89份貝類樣品中有26份含有OA,6份樣品毒素含量超過規定的限量(20μg/100g軟組織),最高的達84mg/100g。隨著海洋污染的加劇,赤潮的經常爆發也增加了有毒藻類的出現,2002年-2004年7月,對北海區十個重點海域進行貝毒檢驗和有毒赤潮生物的調查發現腹瀉性貝毒在大連、煙臺、威海、青島、天津等近岸海域均有分布,染毒的種類主要有蝦夷扇貝(Patinopectenyessoensis)、櫛孔扇貝(Chlamys farreri)、貽貝(Mytilus edulis)和菲律賓蛤仔(Ruditapes variegata)、四角蛤蜊(Mactra Veneriforznis)等經濟貝類。
中毒症狀類似於食物中毒,極易與細菌性胃腸炎混淆,所以從衛生角度上對它們進行檢測特別重要。DSP患者的臨床症狀發生的頻率為:腹瀉92%,噁心79%,腹痛53%,寒顫10%。潛伏期由30min到幾小時,但很少有達到12h,大約70%的患者在4h之內出現症狀,嚴重的病情可持續3d以上,但無後遺症,從未有過死亡病例的報導。雖然腹瀉性貝毒沒有強烈的急性毒性,但OA是強烈的致癌因子,對人體的肝細胞,神經細胞都具有破壞作用,其長期毒性效應當引起足夠重視。
已證實OA是蛋白磷酸酶PP1和PP2A的烈性抑制劑,具有強烈的促腫瘤和致癌作用。由於其多種衍生物均能引起腹瀉症狀而同稱腹瀉性貝毒,可能導致食源性疾病,它們的結構相似,化學性質十分接近,均是聚醚或大環內酯化合物。其引起的中毒症狀包括絞痛,寒顫,噁心,嘔吐,腹瀉,中度至重症腹疼和痙攣,發冷,無致死報導,一般在3d內基本完全康復。極易與細菌性胃腸炎混淆,因此往往未引起足夠的重視,所以從衛生角度上對它們進行檢測特別重要。流行病學和公共衛生的研究證實,OA引起腹瀉症狀,主要是通過激活腸道細胞cAMP介質系統而引起水樣瀉。在細胞和組織中的急性和慢性毒性效應往往表現為細胞凋亡及腫瘤促進,已知肝臟是腹瀉性貝類毒素的靶器官。當細胞內cAMP升高時,依賴cAMP的蛋白激酶被激活,致使一種或多種蛋白質發生磷酸化從而刺激腸隱窩細胞大量分泌水、氯及碳酸鹽,同時抑制腸絨毛細胞對鈉的正常吸收,結果導致嚴重的水瀉。OA的小鼠i.p.LD50為192μg/kgBW、小鼠i.v.LD50為166μg/kgBW、i.p.LD99為160μg/kg。無特效藥治療;檢測也十分困難,其毒素標準品很貴,也很難獲得,中國國內還沒有此毒素的標準品。
毒性作用機制
 細胞凋亡及其信號通路
細胞凋亡及其信號通路由於OA毒性作用機制複雜,因此至今尚未完全闡明其作用機理。對OA的腸道、肝臟、神經毒性研究較為透徹,而對OA通過胎盤屏障引起生殖毒性的研究還相對不足。流行病學研究結果表明,OA是通過激活腸道細胞內cAMP介質系統而引起水瀉。依賴cAMP的蛋白激酶隨著細胞內cAMP的升高而被激活,蛋白質磷酸化,細胞大量分泌水、氯及碳酸鹽,抑制細胞對鈉的正常吸收,從而導致水瀉。Fernández等通過培養小腦神經元研究了OA的神經毒性,OA可能通過電壓依賴的鈣通道(VSSC)增強鈣內流,OA在濃度低至0.5nmol/L時就會產生神經毒性,首先以神經炎的蛻變和細胞體溶脹為特徵,隨後細胞死亡。OA產生的神經毒性不被VSCC對抗物降低,也不被興奮性胺基酸對抗物(EAA)受體降低,VSCC對抗物和EAA受體對抗物完全受KCl去極化的神經毒性所保護。Ma-tias等研究結果發現,OA通過胎盤屏障引起生殖毒性,胎兒組織比肝臟或腎臟包含更多的OA,用9-蒽基重氮甲烷(ADAM)衍生,通過液相色譜和螢光檢測分別為5.60%與1.90%和2.55%。OA的不利影響損害胎兒發育,促進新生兒腫瘤發生。OA是蛋白磷酸酶PP1和PP2A的有效抑制劑已得到了普遍證實,所以它具有誘導癌變和促進凋亡的雙重效應。OA與PP1、PP2A催化亞單位特異性結合,抑制其活性,使體內蛋白質過磷酸化,使細胞產生一系列形態和功能變化,進而導致腹瀉和促進癌變發展。
OA的作用可能與霍亂弧菌相似,通過激活腺苷酸環化酶而引起一系列導致cAMP增加的事件。OA不僅能特異性抑制PP1和PP2A,同時也能刺激許多包括肌漿球蛋白P輕鏈蛋白的磷酸化。PP2A、PP1和PP2B在tau蛋白AD樣異常磷酸化中起重要作用,而tau磷酸化是通過OA敏感型蛋白磷酸酯酶來調節的。疏水性和細胞滲透性好的性質有可能使OA成為一種對OA敏感型磷酸酯酶細胞功能研究的工具藥。OA能誘導多種類型細胞的凋亡,如表皮細胞、神經細胞、髓細胞、造骨細胞和肝細胞等。除人體細胞外,OA對非人體細胞也有誘導凋亡的作用。Goto等和Kawai等一致認為,OA對細胞的凋亡誘導機制與FasL的活化有關,FasL活化後通過自分泌的形式激活了特異性跨膜Fas受體,從而調節了細胞的凋亡活動。OA通過抑制PP1和PP2所介導的OA途徑,在各種器官中普遍促癌,同時具有遺傳毒性。
 OA導致小鼠胚胎細胞凋亡電鏡圖
OA導致小鼠胚胎細胞凋亡電鏡圖OA作用小鼠胚胎細胞凋亡圖冊參考資料。
根據這些酶對抑制劑的敏感性、對陽離子的需求性和體外底物特異性可將他們分為PP-1、PP-2A、PP-2B和PP-2C組。另外一些具有蛋白磷酸酯酶(protein phosphatases,PPP)基因家族的蛋白絲/蘇氨酸磷酸酯酶催化亞單位包括PP-4、PP-5、PP-6和PP-7也被鑑定出。1987年Takai等發現,OA是一種強有力的磷酸酯酶抑制劑,且特異性地抑制PP-1c和PP-2Ac。OA對PP-2Ac的抑制作用比對PP-1c強10-100倍。研究者們認為,這種差異是由PP-2Ac的L7環內胺基酸突變所致。
 OA對肝細胞影響顯微鏡圖
OA對肝細胞影響顯微鏡圖研究發現,OA在短期實驗中能阻止細胞凋亡,而在長期實驗中則無此效應。又如,在細胞培養時間和所用藥物濃度不同條件下,OA對視網膜母細胞瘤腫瘤抑制蛋白磷酸化的影響完全不同。在成神經細胞瘤與神經膠質瘤雜交細胞NG-10815中,OA前處理能使由緩激肽誘導的胞質鈣濃度升高抑制63%,但這種抑制決定於OA的濃度(IC為0.15nmol·L-1)。
OA對肝細胞影響顯微鏡圖。
OA不僅能特異性抑制PP-1c和PP-2Ac,同時也能刺激許多蛋白磷酸化。OA能引起從人臍動脈和兔主動脈中分離出的血管平滑肌持續收縮,這表明OA能引起肌漿球蛋白P輕鏈磷酸化增加。OA引起DSP可能就是通過刺激那些腸細胞內控制鈉離子分泌的蛋白磷酸化。OA通過聯結催化亞單位而抑制磷酸酯酶活性。OA能特異性地抑制磷酸酯酶活性,且疏水性和細胞滲透性好的性質有可能使OA成為一種對OA敏感型磷酸酯酶細胞功能研究的工具藥。
OA已用於阿爾茨海默病(Alzheimer' sdisease,AD)模型研究,來提高各種蛋白主要是微管結合蛋白(microtubule-associatedprotein,MAP)的磷酸化程度。蛋白tau是神經細胞內含量最高的微管結合蛋白,其功能是促進微管組裝並維持微管的穩定性。在AD患者,tau過度磷酸化而失去其上述特有生物功能,並自身聚結為雙螺旋纖絲(pairedhelicalfilaments,PHFs)和神經原纖維纏結(neurofibrillarytangles,NFT)。微管結合蛋白MAP-2和tau異常沉積是AD的一個病理特徵。MAP-2和tau是高度熱穩定性蛋白,但易受磷酸化/去磷酸化速率升高的影響。這些蛋白磷酸化的狀態調節著它們對微管的親和性,從而影響神經細胞骨架的結構。在培養的鼠皮質神經元和一種成神經細胞瘤細胞系(MSN)中,OA能誘導MAP-2和tau磷酸化增加並伴隨早期神經細胞骨架變化,最後導致細胞死亡,表明MAP-2和tau去磷酸化速率降低影響神經細胞骨架的穩定。OA同樣影響星形膠質細胞的變化。AD病人腦中tau蛋白異常磷酸化與蛋白磷酸酯酶調節失衡有關。已知多種蛋白磷酸酯酶,如PP-2A、PP-1和PP-2B在tau蛋白的AD樣異常磷酸化中起重要作用。Harris等利用OA來誘導人腦切片中tau的過磷酸化型,結果表明tau磷酸化以一種劑量依賴方式發生變化。通過OA處理產生的移動最慢型tau,稱為雙螺旋纖絲樣tau(PHF-liketau),能被精製的PP-2B去磷酸化,這說明tau磷酸化是通過OA敏感型蛋白磷酸酯酶來調節。
促癌作用
OA是一族獨特的促癌劑:(1)通過抑制PP-1和PP-2所介導的OA途徑,在各種器官中普遍促癌。(2)OA與teleocidin(一種TPA型促癌劑)同時存在時,在促癌方面並沒有顯示協同效應。(3)2種不同類型的促癌劑OA與TPA共同誘導小鼠皮膚上腫瘤壞死因子α(tumornecrosis factor-alpha,TNF-α)基因的表達。OA通過聯結蛋白磷酸酯酶(PP-1和PP-2A)催化亞單位而抑制他們的活性,從而引起細胞內磷酸蛋白增加。已發現OA能誘導人成纖維細胞中波形蛋白(Vimentin)過磷酸化和細胞角蛋白(Cytokeratin)肽CK5、CK6、CK7、CK16、CK19及27kDa熱休克蛋白(heat shock protein)過磷酸化。同時OA也可誘導體外和體內人成纖維細胞中成視網膜細胞瘤蛋白,以及再生鼠肝核中p53過磷酸化。腫瘤抑制蛋白的過磷酸化與腫瘤促進和體外細胞轉化也與OA的作用有關。另外,經過OA處理的細胞能導致原癌基因c-fos表達增加。由於c-fos能提高染色體的自發畸變水平,通過不斷活化c-fos表達,OA可促進癌形成。Nishina等研究F9胚胎癌性細胞(F9 embryonalcarcinomacells)時發現,OA可誘導c-fun和junB的mRNA水平迅速提高,通過轉錄因子AP-1的活化可引起F9細胞中分化標記的基因表達。
研究者們曾認為,OA的促癌活性是通過對蛋白激酶C(protein kinase c,PKC)信號轉導通路的調控而實現的。OA通過使信號轉導通路中抑制各成份去磷酸化和滅活磷酸酶,活化PKC通路。隨後一些研究小組相繼證實,OA的促癌活性是通過活化絲裂原激活蛋白激酶(mitogen activated pro- teinkinase,MAPK)信號轉導通路來實現的。Thévenin等發現,核因子kappaB(nu-clear factor kappaB,NF-kappaB)可被OA所激活,而NF-kappaB活化需要降解蛋白抑制劑IkappaB-α和IkappaB-β。已經證實經OA處理過的細胞蛋白磷酸化增強及隨後的蛋白抑制劑降解。就IkappaB-α而言,磷酸化增加是通過細胞外常備的蛋白激酶-1(ex-tracellular regular proteinkinases1,ERK-1)的間接活化所介導,而ERK-1則是MAPK家族一成員。OA通過激活MAPK激酶,進一步促使細胞活化與轉化,在DNA複製完成前,促使分化的神經細胞進入有絲分裂期,引起細胞凋亡。OA能誘導成人神經細胞瘤(neuroblastoma)細胞系TR14和NTEN程式性細胞死亡。Taraounas等推斷OA可能活化酪氨酸激酶,因為他們在做經OA處理的老鼠粗線期精母細胞的減數分裂活化實驗中發現,當加入一種酪氨酸激酶抑制劑染料大黃酮(genistein)時,OA對染色體代謝的作用完全消失。
OA在細胞和組織中的急性和慢性毒性效應往往表現為細胞凋亡及腫瘤促進,OA可以通過抑制細胞增殖及誘導細胞凋亡的方式對HL-7702肝細胞產生毒性效應,且呈現劑量-效應關係。而OA在凋亡和癌變兩種相互矛盾的生命取向中都發揮了一定的作用,細胞內的蛋白質去磷酸化主要是由蛋白磷酸酶1和蛋白磷酸酶2A來催化,對蛋白磷酸酶無抑制或只有低抑制作用的物不會導致細胞凋亡。蛋白質磷酸化平衡在細胞是凋亡還是癌變的選擇中發揮了重要作用。胰島素樣生長因子-I(GF-1)可能通過抑制tau蛋白過度磷酸化對OA誘導的細胞損傷具有保護作用。關於OA的促癌機制尚不完全清楚,以前曾有學者發現,OA在促癌過程能誘導細胞凋亡,影響線粒體凋亡通路相關基因和抗氧化基因的表達。但是對於OA促癌的濃度仍需進一步探討。
此外,OA在體外具有顯著的抗癌活性,5μg/L時對KB細胞抑制率為80%,還可誘導體外和體內人成纖維細胞中成視網膜細胞瘤蛋白,再生鼠肝核中p53過磷酸化。
檢測方法
根據聯合國糧農組織(Food and agriculture organizationof the united nations,FAO)於2004年發布的《Marine biotoxins》,可將對於OA的分析方法分為生物學分析檢測法,它包括生物體內試驗(小白鼠生物檢測法、大蚤分析法、大鼠分析法、腸迴路分析法)和生物體外試驗--細胞毒性分析,生物化學分析方法(免疫學方法、蛋白磷酸酶抑制法、生物感測器檢測)以及化學分析檢測法(薄層層析色譜分析法、氣相色譜檢測、毛細管電動色譜檢測法、高效液相色譜及相關聯用檢測技術)。
小白鼠生物檢測法
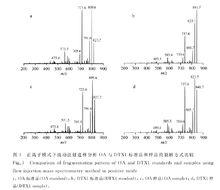
 OA與DTX1毒素標準品和樣品HPLC-MS圖
OA與DTX1毒素標準品和樣品HPLC-MS圖小白鼠生物檢測法(mousebioassy,MBA)適用於所有藻毒素的檢測,被許多國家用來定量檢測毒素的毒力,是最常用的OA檢測方法,其原理是將貝類樣品的酸提液腹腔注射進小鼠體內,並記錄死亡時間,根據麻痹性貝類毒素標準品建立的劑量效應曲線進行樣品毒力的計算,結果用鼠單位(mouseunit,MU)表示(使體重20g的小鼠在15min時死亡的毒力為1個鼠單位)。小鼠生物法套用廣泛,但其存在許多不足之處,如(1)動物使用帶來的倫理問題;(2)靈敏度低,準確性和重現性差,易出現假陽性;(3)不具有特異性,無法確定毒素的成分和含量;(4)所測得的毒性和小鼠的品系有關,可比性較差及分析時間長等問題。因此,快速高效靈敏的檢測方法亟待研究和發展。
理化檢測法
 OA與DTX1標準品和樣品螢光譜圖
OA與DTX1標準品和樣品螢光譜圖薄層層析色譜分析法(thin layerchromatography,TLC)、氣相色譜分析法(gaschromatography,GC)及膠束毛細管電動色譜分析法(micellarelectrokineticchromatography,MEKC)等儀器分析方法均可用於OA的檢測,但在高效液相色譜及相關聯用技術在其研究中套用最多。高效液相色譜法常與螢光檢測或質譜分析聯用,對樣品中的毒素進行定性、定量分析,給出各組分的毒素含量。由於OA分子在紫外光區無吸收,通常利用毒素分子中的羧基與螢光試劑發生衍生反應,使毒素分子具有螢光生色基團後進行高效液相色譜螢光檢測(HPLC with fluorescencedetector,HPLC-FLD),此方法最早由Lee等人採用9-亞甲基重氮蒽(9-anthryldiazomethane,ADAM)對OA衍生生成OA-AM,其衍生化效果好,衍生反應易於操作且檢測靈敏度高而廣泛套用,但ADAM保存條件要求在-80℃而受到限制。螢光劑9-蒽基重氮甲烷雖然具有良好的檢測限,但價格昂貴,化學性質不穩定,容易分解,且分析時間較長,需要1h左右。採用TMAH和9-CA衍生法,OA的檢測限可達到12-20ng/g,且分析時間僅需要15min,適合大批量樣品的檢測。Louppis等利用ADAM作前柱衍生試劑,通過HPLC-FLD法、LC-MS/MS法和鼠生物法檢測OA、DTX-1及其相關酯類,HPLC-FLD方法與LC-MS/MS法檢測結果相關性為100%,和鼠生物法檢測結果相關性為97.1%。袁祺曾利用這一技術對舟山漁場及其鄰近海域腹瀉性貝毒素OA進行了檢測,檢出率高達33%-57%,發現該毒素在中國分布區域較廣,且在某些地區含量較高。
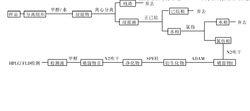 OA的HPLC檢測流程圖
OA的HPLC檢測流程圖隨後出現多種衍生方法,其衍生劑有2,3-(anthracenedicarboximido)ethyltrifluoromethanesulfonate(AE-OTf)、4-溴甲基-7-甲氧基香豆素(4-bromomethyl-7-methoxycoumarin,BrMmc)和BAP,此類方法不能避免大量干擾鋒的出現,如衍生試劑以及未除去的小分子游離脂肪酸等,而這些雜質峰對螢光檢測勢必要造成干擾,同時繁雜的樣品前處理及柱層析成為制約此類方法發展的又一技術難題。液相色譜-質譜法(LC-MS)和液相串聯質譜技術(LC-MS/MS)是檢測OA最有效的方法,其低檢出限可達到ng/g,但因其儀器昂貴,對分析人員的要求高、前處理繁瑣不適用於基層檢測單位對大量樣品的分析,而且大量有機試劑的使用會對環境造成污染。
 OA與DTX1毒素標準品和樣品質譜圖
OA與DTX1毒素標準品和樣品質譜圖中國對海洋生物毒素的檢測分析能力還相對較弱,一些新的檢測技術,如液-質聯用分析技術(LC-MS)等在海洋生物毒素分析方面套用很少,但LC-MS的優勢使其在海洋生物毒素分析方面具有巨大的套用潛力。李愛峰建立了LC-MS分析OA和DTX-1毒素的陰離子檢測方法,檢出限分別為110和220pg;同時建立了LC-MS同步分析OA、DTX-1、GYM、SPX和PTX2等生物毒素的陽離子檢測方法,檢出限分別為49.6、84.6、2.1、2.8和2.9pg。利用這些方法對採集自中國沿海的部分貝類、藻類樣品中的毒素成分進行了分析,通過小鼠生物測試、蛋白磷酸酶活力抑制法及建立的生物學方法得到證實。利用LC-MS技術可同步分析多種毒素,對生物毒素的分析通量和檢測效率大大提高。
免疫學檢測法
 負離子模式下OA與DTX1裂解方式比較
負離子模式下OA與DTX1裂解方式比較免疫學檢測技術(Immunoassays)利用抗原與抗體專一、特異結合的特點,對毒素進行定性定量的檢測,多以單克隆抗體或多克隆抗體為基礎,主要包括酶聯免疫吸附技術(EnzymeLinkedImmunosorbent Assay,ELISA)、放射免疫分析(Radioimmunoassay,RIA)、競爭性酶免疫分析(Competitive EnzymeImmunoassay,EIA)及固態免疫珠檢測(Solid-phaseimmunobeadAssay,S-PIA)等,其中通常採用的方法為ELISA,此方法操作簡單、靈敏度高,適合現場監測和大批量樣品的快速篩選,它不需要非常複雜和昂貴的設備,並能夠實現自動化,其敏感性要比相應的小白鼠生物法和HPLC高。
 正離子模式下OA與DTX1裂解方式比較
正離子模式下OA與DTX1裂解方式比較酶聯免疫吸附技術(ELISA)是將抗原抗體反應的高度特異性和酶的高效催化作用相結合發展建立的一種免疫分析方,其主要是基於抗原或抗體能吸附至固相載體的表面並保持其免疫活性,抗原或抗體與酶形成的酶結合物仍保持其免疫活性和酶催化活性的基本原理。通常用於藻毒素檢測的ELISA 分析方法以單克隆抗體(monoclonalantibody,MAbs)或多克隆抗體(polyclonal antibody,PAbs)為基礎,多種毒素均屬於小分子物質,無抗原性,不能誘導產生抗體,須與載體蛋白偶聯構建完全抗原才能刺激機體引發免疫應答。常用來作為小分子人工抗原的載體蛋白有牛血清白蛋白(BSA)、鑰孔血藍蛋白(KLH)、卵清蛋白(OVA)及人工合成的多聚賴氨酸(PLL)等。單克隆抗體源於一個永久性的細胞譜系,是針對單一抗原決定簇的化學結構完全相同的單一抗體,性質均一,能夠為ELISA 提供與對應抗原高度特異和高度親和的抗體,但在單克隆抗體的製備過程中存在細胞融合、篩選及雜交瘤細胞培養等技術性高、篩選繁瑣的工作步驟,除此之外,腹水及細胞懸浮液不易保存,細胞雜交株分泌特性不穩定等問題也是單抗免疫技術的發展的缺點。多克隆抗體的製備中多種抗原決定簇刺激機體,一系列抗體生成細胞會不同程度的與抗原結合,受抗原刺激後在血液中產生不同類型的抗體,但比單克隆抗體的生產更加簡單快速而且價廉,對複雜表位具有較高的親和力,可以得出異源性廣譜分析,即與相應抗原更廣泛的交叉反應。
Campàs等基於間接競爭ELISA和酶再循環系統開發了電化學免疫感測器檢測技術。利用OA-OVA固定在柵電極,競爭游離和固定的OA單克隆抗體,分別以鹼性磷酸酶(ALP)和辣根氧化酶(HRP)為標記抗體產生信號。標準品檢測限分別為1.07(ALP)和1.98(HRP)μg/L,基於硫辛酸脫氫酶(DI)循環信號放大系統,集成ALP免疫感測器,檢測限降到0.03μg/L,檢測範圍擴大了2個數量級。利用該技術對貽貝和牡蠣提取物進行了檢測,並與比色免疫檢測法、蛋白磷酸酶抑制法(PPIA)及LC-MS/MS法進行對比分析,結果具有良好的相關性。
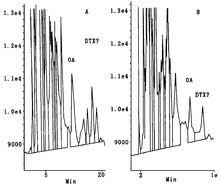 腸腺中OA的HPLC檢測圖
腸腺中OA的HPLC檢測圖螢光偏振免疫分析(FPIA)是均相競爭性免疫分析方法,原理是利用螢光標記的抗原與特異性抗體結合後導致螢光偏振(mp)值發生改變。螢光偏振溶液中包含檢測物質(抗原)、螢光標記物(示蹤物)和特異性抗體。在溶液溫度和粘度固定不變條件下,FP 值將直接與螢光素分子的有效分子大小有關。小分子(如未結合抗體的螢光示蹤物)在溶液中進行快速布朗運動,相應FP 值小,大分子(如螢光示蹤物與抗體結合)FP值則較高。如果檢測樣品中不含有待檢測物質,則示蹤物與抗體結合,FP 值將較高。如果檢測樣品中含有待檢測物質,則與螢光示蹤物競爭抗體位點,這樣未結合狀態螢光示蹤物量將顯著增加,FP 值就會降低。
FPIA相對於其它免疫方法相比有許多優點[5-6]。第一:合成的示蹤物通常都比較穩定,易於保存,並且具有較強的免疫活性;第二:FPIA標準曲線重複性較好,螢光偏振值變異性較低(3%-5%);第三:FPIA是均相反應系統,操作簡單,同時檢測過程中不需要分離結合和未結合的抗體,檢測時間短,易於實現自動化。但是FPIA也有其局限之處。第一:FPIA檢測限一般低於ELISA方法,通常在0.1-10ng之間;第二:FPIA易於受到光散射、樣品中內源性螢光素和樣品基質成分對示蹤物的影響;第三:FPIA需要專門FP測量儀器。
中國對OA 的ELISA 方法的研究建立上也有了許多突破,孫迎春等人首次分泌抗OA MAb 的雜交瘤細胞株。盧士英在此理論基礎上以鼠源單克隆抗體可變區引物擴增並克隆了抗OA 單鏈抗體基因,並建立直接和間接競爭抑制性ELISA方法,確定兩種方法OA 的最低檢出質量濃度分別為0.6 μg/L 和0.18 μg/L。劉仁沿等人用OA-BSA 和OA-KLH 免疫小鼠,分別製備單克隆抗體和多克隆抗體,結果表明OA-KLH 的免疫效果優於OA-BSA,單克隆抗體優於多克隆抗體,此外,劉仁沿等人還對快速檢測OA 的免疫層析試紙條法進行了初步的研究。隨後,王權等人再次用OA-BSA 免疫小鼠得到檢測限為0.175 ng/mL 的單克隆抗體。
蛋白磷酸酶抑制法
蛋白磷酸酶抑制法(protein phosphataseinhibition assay,PPIA),該方法利用OA對PP2A酶活力抑制特性,選擇一種在酶催化反應後能產生螢光產物的物質作底物,根據產物產生的速率來表示酶活力受抑制程度,進而計算抑制劑OA濃度。最初以硝基苯磷酸鹽為底物,改進後以磷酸甲基酮為底物。酶活力抑制法具有定量準確、檢測靈敏、重現性好、回收率高等優點,不足的是只能給出反映毒性相對大小的數據,不能給出毒素組成成分,且酶價格較高,所用多通道連續分光/螢光光度計也不普及,限制了其廣泛套用。李愛峰等利用酶活力抑制法建立了OA的檢測方法,有效檢測範圍為0.75-30nmol/L,貝組織中OA檢出限為0.9μg/kg。其他腹瀉性貝毒成分對蛋白磷酸酶有同樣的抑制作用,但此法卻不能鑑定。Prassopoulou等利用鼠生物法,PP2A抑制法(試劑盒)、HPLC-FLD法檢測OA,HPLC-FLD檢測限為5.86μg/kg,3種檢測方法比較,結果顯示出極好的一致性。該方法繼承了鼠生物法能直接建立劑量-效應關係的優勢,顯著降低了檢出限,可在短時間內檢測大量樣品,有望發展成為一種標準檢測方法。
生物感測器
生物感測器(Biosensor)是將生物活性物質固定在某種特殊材料上作為識別元件與適當的理化換能器(如氧電極、光敏管、壓電晶體等)及信號放大裝置構成的分析工具。根據分子部件的不同,可分為酶感測器、微生物感測器、免疫感測器及DNA 感測器等,根據信號轉換部分的不同,可分為電化學、半導體、生物電極等生物感測器。因其操作簡便、可重複使用、可實現連續線上監控等優點,在環境污染及食品安全得到廣泛研究,而其在赤潮毒素檢測的套用上的研究也在不斷發展和更新。用於檢測OA的生物感測器主要以免疫學為基礎,根據ELISA 分析的反應原理,利用抗原抗體結合產生的某些理化性質的改變來進行分析,其次還有以蛋白磷酸酶抑制法(PPIA)為基礎,利用OA 和DTXs 毒素對蛋白磷酸酶抑制的特性製作的生物感測器。生物感測器的形式主要分兩類,一類是表面電漿共振技術(Surface PlasmonResonance,SPR)製成的感測器,另一類是電化學反應製成的生物感測器。
Volpe等組裝電化學探針用於監控OA對PP2A的抑制。PP2A具有肝糖磷酸化酶(PHOSa)特性,能催化肝糖轉化成葡萄糖-1-磷酸鹽(G-1-P)。而PP2A受OA及其同系物的強烈抑制,根據這一特性,將PP2A套用於開發離線酶培育檢測系統中(OA/PP2A,PP2A/PHOSa,PHOSa/肝糖+磷酸鹽),通過酶反應的最終產物過氧化氫(H2O2)進行電化學檢測,即糖原(glycogen)轉化為G-1-P,與鹼性磷酸酶(AP)反應產生葡萄糖(glucose,G),G與葡萄糖氧化酶(GOD)反應生成H2O2。AP與GOD兩種酶固定在尼龍網薄膜上,其上嵌入流動注射分析(FIA)系統的H2O2鉑探針。校準後的檢測系統工作範圍是30-250 pg/mL,生物感測器回響時間為4 min。
