分子力
分子力又稱分子間作用力、范得瓦耳斯力,是指分子間的相互作用。當二分子相距較遠時,主要表現為吸引力,這種力主要來源於一個分子被另一個分子隨時間迅速變化的電偶極矩所極化而引起的相互作用;當二分子非常接近時,則排斥力成為主要的,這是由於各分子的外層電子云開始重疊而產生的排斥作用。
分子間的引力和斥力
分子間存在引力
1.分子間雖然有間隙,大量分子卻能聚集在一起形成固體或液體,說明分子間存在引力;
2.用力拉伸物體,物體內要產生反抗拉伸的彈力,說明分子間存在引力;
3.兩個物體能粘合在一起,說明分子間存在引力。分子間存在斥力
1.分子間有引力,卻又有空隙,沒有被緊緊吸在一起,說明分子間有斥力;
2.用力壓縮物體,物體內要產生反抗壓縮的彈力,說明分子間有斥力。分子間引力和斥力的變化情況

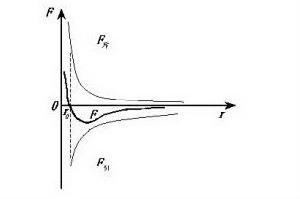
分子間引力和斥力隨分子間的距離的增大而減小,隨分子間的距離的減小而增大,且斥力減小或增大比引力變化要快些。
1.當r=ro(ro=10^-10米)時,分子間的引力和斥力相平衡,分子力為零,此位置叫做平衡位置;
2.當r<ro時,分子間斥力大於引力,分子力表現為斥力;
3.當r>ro時,分子間引力大於斥力,分子力表現為引力;
4.當r≥10ro時,分子間引力和斥力都十分微弱,分子力為零;
5.當r由ro→∞時,分子力(引力)先增大後減小。分類
分子間作用力實際上是一種電性的吸引力,從這個意義上講,分子間作用力可以分為以下三種力:取向力
發生在極性分子與極性分子之間。由於極性分子的電性分布不均勻,一端帶正電,一端帶負電,形成偶極。因此,當兩個極性分子相互接近時,由於它們偶極的同極相斥,異極相吸,二個分子必將發生相對轉動。這種偶極子的相互轉動,就使偶極子的相反的極相對,叫做“取向”。這種由於極性分子的取向而產生的分子間的作用力,叫做取向力。誘導力
發生在極性分子與非極性分子之間以及極性分子之間。在極性分子和非極性分子間,由於極性分子的影響,會使非極性分子的電子云與原子核發生相對位移,產生誘導偶極,與原極性分子的固有偶極相互吸引,這種誘導偶極間產生的作用力叫誘導力。同樣地極性分子間既具有取向力,又具有誘導力。色散力
當非極性分子相互接近時,由於每個分子的電子不斷運動和原子核的不斷振動,經常發生電子云和原子核之間的瞬時相對位移,產生瞬時偶極。而這種瞬時偶極又會誘導鄰近分子也產生和它相吸引的瞬時偶極。由於瞬時偶極間的不斷重複作用,使得分子間始終存在著引力,因其計算公式與光色散公式相似而稱為色散力。
