警示語
警告:請注意禁止與本品合用的藥物
請閱讀“禁止與本品合用的藥物和注意事項”部分
成份
本品為複方製劑, 每片含洛匹那韋200mg,利托那韋50mg。
性狀
本品為橢圓形紅色薄膜衣片,除去包衣後顯白色或類白色。
適應症
本品適用於與其它抗反轉錄病毒藥物聯合用藥,治療成人和2歲以上兒童的人類免疫缺陷病毒-1(HIV-1)感染。
有關洛匹那韋利托那韋的用藥經驗主要來自於未接受過抗反轉錄病毒藥物治療的患者。已接受過蛋白酶抑制劑治療的患者數據非常有限。在洛匹那韋利托那韋治療失敗的情況下對患者進行補救治療的數據也非常有限。
已接受過蛋白酶抑制劑治療的HIV-1感染者是否選擇本品治療主要取決於兩個因素,即患者個體的病毒耐藥檢測結果及其治療史。
規格
每片含洛匹那韋200mg和利托那韋50mg。
用法用量
應由對治療HIV感染有臨床經驗的醫生開具本品處方。
本品應該整片吞咽,不能咀嚼、掰開或壓碎。
成人和青少年
本品的推薦劑量為400/100mg(2片),每日兩次。可以與食物同服或不與食物同服。對於成年患者,出於對患者管理的考慮,需要按每日一次的方式服藥時,本品的給藥劑量可以為800/200mg(4片),每日一次,可以與食物同服或不與食物同服。每日一次的用藥方法應限於僅有極少蛋白酶抑制劑(PI)相關性突變的成年患者中(即,小於3種PI突變,且與臨床試驗結果一致,對於人群的詳細描述參見【藥理毒理】),同時應考慮到與每日兩次的推薦標準用藥方法相比,每日一次用藥對病毒的持續抑制作用較弱(參見【藥理毒理】),發生腹瀉的風險會增加(參見【不良反應】)。
兒童(2歲及2歲以上)
本品的推薦劑量400/100mg(2片),每日兩次,可以用於體重大於等於40kg的兒童或體表面積
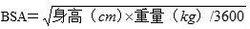 克力芝
克力芝大於1.4m2的兒童。對於體重小於40 kg或者BSA在0.6和1.4 m2之間並且可以吞服藥片的兒童,用藥劑量請參考本品100/25mg的用法用量。每日一次的用藥方法未在兒童患者中得到驗證。
兒童(2歲以下)
由於缺乏足夠的安全性和有效性數據,故不推薦2歲以下的兒童服用本品。
合併治療:依非韋侖或奈韋拉平
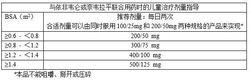
下列表格包含了兒童在本品與依非韋侖或奈韋拉平聯合用藥時,基於BSA的給藥方案。
 克力芝
克力芝肝功能不全
在伴有輕至中度肝功能不全的患者中,洛匹那韋的暴露劑量約增加30%,但該增加量與臨床治療無明確的相關性。目前尚未有伴重度肝功能不全患者的數據,這些患者不應該使用本品。
腎功能不全
因為洛匹那韋和利托那韋經腎臟的清除率微乎其微,所以腎功能不全的患者不會發生血藥濃度升高。由於洛匹那韋和利托那韋均具有很強的蛋白結合能力,因此血液透析或腹膜透析不會顯著影響其清除。
不良反應
a. 安全性概述
納入2600多名患者的II IV期臨床試驗對本品的安全性進行了評估,其中700多名患者使用的是800/200 mg(4片)每日一次的治療劑量。在使用核苷類反轉錄酶抑制劑(NRTIs)的情況下,在一些研究中,本品與依非韋侖或奈韋拉平聯合用藥。
臨床試驗期間與本品治療相關的最常見的不良反應為腹瀉、噁心、嘔吐、高甘油三酯血症和高膽固醇血症。每日一次服用本品的患者發生腹瀉的風險可能較大。腹瀉、噁心和嘔吐在治療開始的時候就可能出現,高甘油三酯血症和高膽固醇血症可能會稍後出現。在II-IV期試驗中,有7%的受試者因在治療中出現不良事件而導致提前退出研究。
值得注意的是,接受本品治療的患者中已有發生胰腺炎的報告,包括那些出現了高甘油三酯血症的患者。此外,在本品治療過程中出現PR間期延長的報告極為罕見(參見【注意事項】中胰腺炎和脂質升高)。
b. 不良反應列表
成人和兒童患者在臨床試驗中和上市後使用中發生的不良反應:
納入2600多名患者的II IV期臨床試驗對本品的安全性進行了評估,其中700多名患者使用的是800/200 mg(4片)每日一次的治療劑量。在使用核苷類反轉錄酶抑制劑(NRTIs)的情況下,在一些研究中,本品與依非韋侖或奈韋拉平聯合用藥。
以下事件已被確定為不良反應。頻率分級中包括了所有已報告的中度至重度事件,無論是否存在因果關係。根據身體系統器官分類列出了不良反應,在每個頻率分組中,不良反應發生頻率按降序排列:極常見≥1/10;常見≥1/100,<1/10;不常見≥1/1000,<1/100。
給出頻率為“不明”的事件在上市後監測中被確認。
 克力芝
克力芝c. 部分不良反應描述
在接受利托那韋和吸入或鼻內使用丙酸氟替卡松的患者中有發生庫欣氏綜合徵的報告;使用通過P450 3A代謝的其它皮質激素(布地奈德)也可能出現這種情況(參見【注意事項】和【藥物相互作用】)。
在套用蛋白酶抑制劑,特別是與核苷類反轉錄酶抑制劑聯合用藥時會有肌酸磷酸激酶(CPK)增高,肌痛、肌炎和橫紋肌溶解(罕見)的報告。
聯合抗反轉錄病毒藥物治療的HIV患者會出現身體脂肪的再分布(脂營養不良),包括外周和面部皮下脂肪減少、腹內和內臟脂肪增多、乳房肥大和頸背面脂肪積聚(水牛背)。
聯合抗反轉錄病毒藥物治療可出現代謝異常,比如高甘油三酯血症、高膽固醇血症、胰島素抵抗、高血糖症和高乳酸血症(參見【注意事項】)。
在開始聯合抗反轉錄病毒藥物治療(CART)時已處於嚴重免疫缺陷狀態的愛滋病患者,可能會出現無症狀感染或者殘留機會感染所引起的炎症反應(參見【注意事項】)。
曾有報告發生骨壞死的病例,特別是存在有公認的風險因素的患者、晚期愛滋病患者或長期接受聯合抗反轉錄病毒藥物治療(CART)的患者。其發生頻率尚不明(參見【注意事項】)。
d. 兒童
本品在2歲或2歲以上兒童中的安全性特徵與在成人中觀察到的安全性特徵相似(參見以上b小節中的表格)。
禁忌
本品禁用於已知對洛匹那韋、利托那韋或任何輔料過敏的患者。
本品禁用於重度肝功能不全的患者。
本品中含有洛匹那韋和利托那韋,兩者都是細胞色素P450異構體CYP3A的抑制劑。本品不能與那些主要依賴CYP3A進行清除且其血藥濃度升高會引起嚴重和/或致命不良事件的藥物同時服用。這類藥物包括
 克力芝
克力芝注意事項
合併有併發症的患者
肝功能不全:本品在有嚴重肝臟疾病患者中使用的安全性和有效性尚未確定。重度肝功能不全的患者禁用本品。同時套用抗反轉錄病毒藥物聯合治療的慢性B肝或C肝患者發生嚴重和潛在致命性肝臟不良反應的危險性會增加。如果B肝或C肝患者同時合併抗病毒藥物治療,用藥時請參閱這些藥物的相關產品信息。
原有肝功能損害(包括慢性肝炎)的患者,其在進行抗反轉錄病毒藥物聯合治療的過程中發生肝功能異常的危險性會升高,應根據經驗對這類患者用藥期間的肝功能狀態進行監測。如果有證據表明這類患者的肝臟疾病惡化,應考慮中斷或終止治療。
曾有HIV-1單獨感染者和接觸病毒後進行暴露後預防的個體在開始接受洛匹那韋/利托那韋與其他抗反轉錄病毒藥物聯合治療後7天即出現轉氨酶水平升高,伴隨或不伴隨膽紅素水平升高的報告。有些病例的肝功能損害嚴重。在開始洛匹那韋/利托那韋治療前要進行適當的實驗室檢測,在治療期間還應進行密切監測。
腎功能不全:因為洛匹那韋和利托那韋經腎臟的清除率微乎其微,因此腎功能不全的患者不會發生血藥濃度升高。由於洛匹那韋和利托那韋均具有很強的蛋白結合能力,因此血液透析或腹膜透析不會顯著影響其清除。
血友病:曾有A型或B型血友病患者接受蛋白酶抑制劑治療時發生出血增多的報告,包括自發性皮膚血腫和關節積血。有些患者接受了額外的Ⅷ因子治療。報告病例中一半以上繼續或重新使用蛋白酶抑制劑進行治療。雖然引起出血的作用機理尚未闡明,但蛋白酶抑制劑治療與出血之間的因果關係已引起了關注。因此,應當意識到在血友病患者中使用蛋白酶抑制劑有增加出血的可能。
脂質升高
套用本品治療有時可引起總膽固醇和甘油三酯濃度較大幅度升高。在開始用本品治療前以及治療過程中應定期檢測甘油三酯和膽固醇水平。對於甘油三酯和膽固醇基礎水平較高以及有血脂異常病史的患者,用藥時應特別謹慎。可以通過適當的臨床措施對血脂異常進行處理。
胰腺炎
在接受本品治療的患者中有發生胰腺炎的報告,也有一些患者發生了高甘油三酯血症。絕大多數報告病例中,患者系既往有胰腺炎罹患病史和/或與其它可引發胰腺炎的藥物進行合併治療。甘油三酯顯著升高是發生胰腺炎的一個危險因素。中晚期愛滋病患者可能會有甘油三酯升高和發生胰腺炎的危險。
如果出現臨床症狀(噁心、嘔吐和腹痛)或者實驗室檢查異常(如血清脂肪酶或澱粉酶升高),應考慮發生胰腺炎的可能。應對出現這些症狀或體徵的患者進行評估,如果診斷為胰腺炎,應暫時停止本品的治療。
高血糖
在接受蛋白酶抑制劑治療的患者中有新發糖尿病、高血糖症或原有糖尿病加重的病例報告。其中一些高血糖症患者病情嚴重,甚至還會發生酮症酸中毒。多數患者臨床病症複雜,其中部分患者還需要接受藥物治療,而這些藥物本身也與糖尿病或者高血糖症的發生有關。
脂肪再分布和代謝紊亂
接受聯合抗反轉錄病毒藥物治療的HIV患者會出現身體脂肪的再分布(脂代謝障礙)。對於這些不良事件的長期後果目前尚不明確。對作用機制的了解也並不全面。有假設認為,內臟脂肪瘤樣變與蛋白酶抑制劑(PIs)、脂代謝障礙和核苷類反轉錄酶抑制劑(NRTIs)之間存在關聯。脂代謝障礙的高危險性主要取決於個體因素如年齡較大、藥物相關因素如長期接受抗反轉錄病毒藥物治療和代謝紊亂等。臨床檢查過程中應對脂肪的再分布進行評估。應該考慮進行空腹血脂和血糖的測定。可以通過適當的臨床措施對血脂異常進行處理。
免疫重建綜合徵
在開始聯合抗反轉錄病毒藥物治療(CART)時已處於嚴重免疫缺陷狀態的愛滋病患者,可能會出現無症狀感染或者殘留機會感染所引起的炎症反應並導致嚴重的臨床狀況或使當前症狀加重。通常情況下,這種反應會在開始CART後的幾周或幾個月內出現。相關病例有巨細胞病毒視網膜炎、全身性和/或局部性分枝桿菌感染以及肺孢子菌肺炎。對所有的炎症症狀均應進行評估並在必要時採取治療措施。
骨壞死
雖然骨壞死的病因有多種因素(包括使用皮質類固醇、飲酒、嚴重的免疫抑制反應、體重指數較高等),但是在中晚期愛滋病患者和/或長期接受聯合抗反轉錄病毒藥物治療(CART)的患者中發生骨壞死的病例尤其多見。應該告知患者,如果出現關節疼痛、關節僵硬或者行動困難時,應去醫生處診治。
PR間期延長
一些健康成人受試者服用洛匹那韋利托那韋後出現輕度的無症狀性PR間期延長。如患者存在結構性心臟疾病和原有傳導系統異常或者接受可引起PR間期延長的藥物(如維拉帕米或阿扎那韋),則在接受洛匹那韋利托那韋後有罕見報導發生2度或3度房室傳導阻滯。本品在這類患者中使用時應當謹慎。
藥物相互作用
本品含有洛匹那韋和利托那韋,二者都是細胞色素P450異構體CYP3A的抑制劑。本品很可能會增加主要通過CYP3A進行代謝的藥物血藥濃度。在合併套用本品的治療過程中會導致這類藥物的血藥濃度升高或治療作用延長及導致不良事件的發生。
不能伴隨給予秋水仙鹼,尤其是在腎或肝功能損害患者中。
不建議本品與以下藥物合併給藥:
-他達拉非(適用於治療肺動脈高血壓)
-不推薦骨關節感染患者使用夫西地酸
-沙美特羅
-利伐沙班
不推薦本品與阿托伐他汀聯合用藥。若必須使用阿托伐他汀,則套用最小劑量的阿托伐他汀且作好安全性監測。如洛匹那韋利托那韋與羅舒伐他汀合併套用時必須謹慎且應減少聯合用藥的劑量。如果患者有接受HMG-CoA還原酶抑制劑治療的適應症,推薦使用普伐他汀或氟伐他汀這兩種藥物。
PDE5抑制劑:在接受本品治療的患者中,套用西地那非和他達拉非治療勃起功能障礙時,應該特別謹慎。這些藥物和本品合用時被認為可導致這些藥物濃度連續增加,從而增加例如低血壓、暈厥、視覺改變和勃起時間延長等不良事件。伐地那非禁止與本品合用。西地那非用於治療肺動脈高壓時禁止與本品合用。
在聯合套用本品和可誘導QT間期延長的藥物如氯苯那敏、奎尼丁、紅黴素、克拉黴素時要特別謹慎。本品會增加聯用藥物的血藥濃度並可能進而導致藥物相關的心臟不良事件增多。在臨床前研究中有與本品聯合用藥而引發心臟不良事件的報告;因此目前不能排除本品具有潛在的心臟效應。
不推薦本品與利福平聯合用藥。利福平與本品聯合用藥後會顯著降低洛匹那韋的血藥濃度並進而影響洛匹那韋的治療效果。增加本品的用藥劑量可以使洛匹那韋利托那韋達到適宜的治療水平,但同時也有增加患者肝臟和胃腸道毒副作用的危險。因此除非絕對必要,否則應避免本品與利福平聯合用藥。
其它
本品並不能治癒HIV感染或愛滋病(AIDS)。本品不能降低愛滋病病毒通過性接觸或血液傳染給他人的危險性。應採取適當的預防措施。接受本品治療的患者仍可能被感染或者出現與HIV和AIDS有關的其它疾病。
除非確定潛在治療作用大於發生全身性糖皮質激素效應的危險性,包括庫興氏綜合徵和腎上腺抑制,否則不推薦本品與通過CYP3A4代謝的藥物氟替卡松或者其它糖皮質激素聯合套用。
對駕駛和操作機器能力的影響
雖然未證實本品對駕駛和操作機器能力有影響,應告知患者曾有服用本品過程中發生噁心的報導。
孕婦及哺乳期婦女用藥
孕婦服用本品的安全性數據尚未建立。動物實驗證明本品具有生殖毒性。對人類的潛在危險尚未知。除非必要,孕婦應避免套用本品。
大鼠研究顯示,洛匹那韋可以通過乳汁分泌。洛匹那韋是否可通過人類乳汁分泌尚不清楚。感染HIV的產婦不應母乳餵養嬰兒,以避免出生後的HIV傳播。
兒童用藥
由於缺乏足夠的安全性和有效性數據,故不推薦2歲以下的兒童服用本品。
老年用藥
未進行該項試驗且無可靠參考文獻。
藥物相互作用
本品中含有洛匹那韋和利托那韋,二者都是細胞色素P450異構體CYP3A的體外抑制劑。本品與主要通過CYP3A進行代謝的藥物聯合套用時可能會增加這些藥物的血藥濃度,並進而導致藥物作用時間延長和增加不良反應的發生。在臨床用藥濃度範圍內,本品不會抑制CYP2D6、CYP2C9、CYP2C19、CYP2E1、CYP2B6或CYP1A2的活性。
已經證明本品在體內能夠誘導其自身代謝,並且可以增加一些藥物的生物轉化,這些藥物通過細胞色素P450酶系(包括CYP2C9和CYP2C19)和與葡萄糖醛酸結合進行代謝。這有可能降低這類合用藥物的血藥濃度並進而影響到藥物的療效。
禁止聯合使用已知存在明顯相互作用和會引起嚴重不良事件發生的藥物。
除非有特殊說明,否則所有藥物相互作用研究均套用的是洛匹那韋利托那韋軟膠囊,洛匹那韋軟膠囊的暴露量較200/50 mg片劑約低20%。
本品與選定的抗反轉錄病毒藥物和非抗反轉錄病毒藥物以及其它藥物之間已知的和理論上的相互作用如下表所示(“↑”表示增加;“↓”表示降低;“↔”表示無變化;“QD”表示每日一次;“BID”表示每日兩次;“TID”表示每日三次)。
除非有特殊說明,否則以下研究所用洛匹那韋利托那韋的劑量為400/100 mg每日兩次。
 克力芝
克力芝藥物過量
迄今為止,患者使用本品急性過量的事件極少見。
在實驗犬中觀察到的不良臨床症狀包括流涎、嘔吐和腹瀉/大便異常。在小鼠、大鼠或實驗犬中觀察到的毒性反應包括活動減少、共濟失調、消瘦、脫水和震顫。
本品過量沒有特效解毒劑。本品過量的處理應採取包括監測生命指征和觀察患者臨床症狀在內的一般支持性治療措施。如有指征,可通過嘔吐或洗胃清除未吸收的藥物活性成份。還可使用活性炭輔助清除未吸收的藥物。因為本品的蛋白結合率很高,透析可能無助於大量清除藥物。
藥理毒理
藥理作用
作用機理
本品為洛匹那韋與利托那韋組成的複方製劑。洛匹那韋是一種HIV蛋白酶抑制劑,可以阻斷Gag-Pol聚蛋白的分裂,導致產生未成熟的、無感染力的病毒顆粒;利托那韋是一種針對HIV-1和HIV-2天冬氨醯蛋白酶的活性擬肽類抑制劑,通過抑制HIV蛋白酶使該酶無法處理Gag-Pol多聚蛋白的前體,導致生成非成熟形態的HIV顆粒,從而無法啟動新的感染周期。利托那韋可抑制CYP3A介導的洛匹那韋代謝,從而產生更高的洛匹那韋濃度。
抗病毒活性
分別在急性感染的淋巴母細胞系和外周血淋巴細胞中檢測了洛匹那韋對實驗室HIV株和臨床HIV分離病毒株的抗病毒活性。在不加人血清的情況下,洛匹那韋對五種不同HIV-1亞型B的實驗室病毒株的50%有效濃度(EC)在10~27nM (0.006~0.017μg/mL, 1μg/mL=1.6μM)之間,對幾種臨床分離毒株的50%有效濃度在4~11nM (0.003~0.007μg/mL)之間(n=6)。在含50%人血清時,洛匹那韋對這五種實驗室毒株的EC平均為65~289nM (0.04~0.18μg/mL),相當於減弱了7-11倍。與洛匹那韋聯合用藥的體外抗病毒藥物活性研究顯示,洛匹那韋與奈非那韋聯合套用會增加拮抗作用,與安潑那韋、阿扎那韋、茚地那韋、沙奎那韋和替拉那韋聯合套用會增加協同作用。洛匹那韋對三種不同HIV-2 病毒株的EC值在12~180nM (0.008~113 μg/mL)之間。
耐藥性
已在體外篩選出了對洛匹那韋敏感性下降的HIV-1分離株。利托那韋的存在似乎不影響對洛匹那韋耐藥病毒株的體外篩選。
目前尚未確定未接受過抗反轉錄病毒治療的患者對本品耐藥性的選擇作用。在一項III期研究中,包括653例未接受過抗反轉錄病毒治療的患者,在第24、32、40和/或48周時血漿HIV載量大於400拷貝/mL的患者,對其血漿病毒分離株進行分析。37例經洛匹那韋/利托那韋治療的可評價患者中,未發現對洛匹那韋/利托那韋產生耐藥的證據(0%)。未接受過抗反轉錄病毒治療的兒童患者中,洛匹那韋/利托那韋耐藥性的選擇作用與成年人中的情況似乎是一致的。
在洛匹那韋/利托那韋治療之前接受過其他蛋白酶抑制劑治療的患者中,曾有發生對洛匹那韋/利托那韋的耐藥。在一項有227名未接受過抗反轉錄病毒治療和接受過蛋白酶抑制劑治療的患者參加的II期試驗中,用洛匹那韋/利托那韋治療12~100周后其體內病毒RNA可定量(>400拷貝/mL)的23名患者中,有4名患者的分離株對洛匹那韋的敏感性與相應基線病毒分離株相比顯著下降。這些患者中有3名以前接受過蛋白酶抑制劑單藥(茚地那韋、奈非那韋或沙奎那韋)治療,1名接受過多個蛋白酶抑制劑(茚地那韋、利托那韋和沙奎那韋)治療。在接受洛匹那韋/利托那韋治療前,4名患者都有四處以上與蛋白酶抑制劑耐藥性有關的突變。出現病毒學反彈後,這些患者的分離毒株的突變點均增多,其中一些與蛋白酶抑制劑耐藥性有關。但是目前尚無充分的數據對洛匹那韋/利托那韋治療患者中分離的病毒株中與洛匹那韋有關的突變模式進行鑑定。目前正在對這些突變模式進行研究。
交叉耐藥性-臨床前研究
在HIV蛋白酶抑制劑中觀察到了不同程度的交叉耐藥性。有關在洛匹那韋/利托那韋治療過程中對洛匹那韋敏感性下降的病毒交叉耐藥性的資料很有限。
研究者對早先使用過單一蛋白酶抑制劑的患者的臨床分離株進行了洛匹那韋體外活性測定。對奈非那韋(n=13)和沙奎那韋(n=4)敏感性下降4倍以上的分離株,對洛匹那韋的敏感性下降倍數低於4倍。對茚地那韋(n=16)和利托那韋(n=3)敏感性下降4倍以上的分離株,對洛匹那韋的敏感性分別下降了5.7和8.3倍。以前接受過兩個或更多蛋白酶抑制劑治療的患者的分離株對洛匹那韋的敏感性下降程度更大,如下所述。
臨床研究-已接受過蛋白酶抑制劑治療的患者套用洛匹那韋/利托那韋的抗病毒活性
通過分析接受過洛匹那韋/利托那韋治療的患者對洛匹那韋/利托那韋的病毒學應答,與基線病毒基因型(三項研究)和基線病毒表型(一項研究)相比較,評價了洛匹那韋體外敏感性降低的臨床意義。
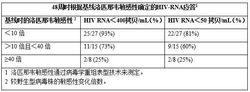
洛匹那韋/利托那韋的病毒學反應受基線時蛋白酶中出現的以下三個或更多胺基酸替換的影響:L10F/I/R/V、K20M/N/R、L24I、L33F、M36I、I47V、G48V、I54L/T/V、V82A/C/F/S/T和I84V。下表給出根據研究888和765(參見【適應症】和【用法用量】)以及研究957(見下表)中基線時上述蛋白酶抑制劑耐藥性突變數目確定的48周的病毒學應答(HIV RNA<400拷貝/mL)。對於出現三個或更多上述胺基酸替換的成人患者不推薦一日一次的用法用量。
 克力芝
克力芝在研究957中對與洛匹那韋基線表型敏感性有關的洛匹那韋/利托那韋治療的病毒學應答進行了測定。本研究包括56例未接受過NNRTI治療的患者,這些患者以前至少用過2種蛋白酶抑制劑(茚地那韋、奈非那韋、利托那韋、沙奎那韋),但HIV RNA的載量仍大於1000拷貝/mL,這些患者隨機接受與依非韋侖和核苷類反轉錄酶抑制劑(NRTIs)聯合使用的洛匹那韋/利托那韋的兩個劑量中的一個劑量。洛匹那韋對56株基線病毒分離株的EC50值為野生型病毒株EC50值的0.5~96倍。55%(31/56) 的基線分離株對洛匹那韋的敏感性降低4倍以上。這31株病毒株對洛匹那韋的敏感性降幅的中位值為18倍。下表給出了根據基線洛匹那韋敏感性確定的治療應答。
 克力芝
克力芝毒理研究
遺傳毒性
洛匹那韋和利托那韋Ames試驗、小鼠淋巴瘤細胞試驗、人淋巴細胞染色體畸變試驗及小鼠微核試驗結果均為陰性。
生殖毒性
洛匹那韋和利托那韋以2:1比例聯合給藥時,10/5、30/15或100/50mg/kg/日的劑量下均未見對雄性和雌性大鼠生育力的影響。根據AUC測定值,100/50 mg/kg/日劑量下雄性和雌性大鼠洛匹那韋和利托那韋暴露量約分別為人在推薦治療劑量(400/100 mg、每日2次)下暴露量的0.7倍和1.8倍。
妊娠大鼠或家兔給予洛匹那韋/利托那韋,未見與給藥相關的胎仔畸形。在母體中毒劑量(100/50 mg/kg/日)下,大鼠中可見胚胎和胎仔發育毒性(早期吸收、胎仔運動能力下降、胎仔體重下降、骨骼變異發生率增高和骨骼骨化延遲)。
家兔在母體中毒劑量(80/40 mg/kg/日)下未見胚胎和胎仔發育毒性。根據AUC測定值,家兔在80/40 mg/kg/日劑量下的洛匹那韋和利托那韋暴露量約為人類在推薦治療劑量(400/100 mg、每日2次)下暴露量的0.6倍和1.0倍。
在一項大鼠圍產期毒性試驗中,洛匹那韋/利托那韋在40/20 mg/kg/日及更大劑量下具有發育毒性(分娩過程中及產後21天內新生仔鼠的存活率降低)。
致癌性
小鼠和大鼠連續104周經口給予洛匹那韋/利托那韋,結果顯示,當給藥劑量近似於人推薦劑量(400/100mg、每日2次)下暴露量(基於AUC測量)的1.6-2.2倍(小鼠)、0.5倍(大鼠)時,雄性和雌性小鼠以及雄性大鼠良性肝細胞腺瘤發生率以及肝細胞腺瘤和癌的聯合發生率上升。
利托那韋的致癌作用已經在小鼠和大鼠中進行了研究。在雄性小鼠中,腺瘤發生率、腺瘤和肝癌聯合的發生率呈現劑量依賴性的增高。基於AUC測量結果,試驗中雄性小鼠在高劑量下的暴露量近似於人類在推薦治療劑量(本品400/100mg、每日2次)下暴露量的4倍。在此劑量下,在雌性小鼠中未見腫瘤發生率升高。雌性小鼠在高給藥劑量下的暴露量相當於人類暴露量的9倍。大鼠中未見腫瘤發生率升高,大鼠在高劑量下的暴露量近似於人類在推薦劑量(400/100mg、每日2次)下暴露量的0.7倍。根據動物試驗獲得的暴露量數據,所觀察到效應的意義尚不清楚。
藥代動力學
人們已對洛匹那韋與利托那韋合併給藥時在健康成年志願者和HIV感染患者的藥代動力學特性進行了研究;這兩組人群間沒有明顯差異。洛匹那韋基本上全部由肝臟CYP3A代謝。利托那韋抑制肝臟CYP3A對洛匹那韋的代謝,從而提高洛匹那韋的血漿濃度。在不同試驗中,HIV感染患者服用本品400/100 mg每日兩次後,所得洛匹那韋的平均穩態血漿濃度比利托那韋高15-20倍。利托那韋血漿濃度比利托那韋按600mg每日兩次給藥所得濃度的7%還低。洛匹那韋的體外抗病毒EC50約比利托那韋低10倍。因此,本品的抗病毒活性是由洛匹那韋產生的。
吸收:
多次給予本品(400/100mg每日兩次,無飲食限制,持續用藥2周),約在用藥4小時後洛匹那韋血藥濃度達峰,其峰值(Cmax)為12.3±5.4μg/mL。清晨給藥前的平均穩態谷濃度為8.1±5.7μg/mL。超過12小時給藥間隔的洛匹那韋AUC為113.2±60.5μg·h/mL。洛匹那韋利托那韋在人體的絕對生物利用度尚未確定。
食物對口服吸收的影響:與禁食狀態相比,單劑量的本品400/100mg與食物同服(高脂肪飲食,872千卡,56%熱量來自脂肪),其AUC和C的改變沒有顯著性臨床意義。因此,本品可以與食物同服或不與食物同服。與克力芝軟膠囊相比,在與食物同服的條件下,本品的藥代動力學變異較少。
分布:
穩態時,洛匹那韋約有98-99%與血漿蛋白結合。洛匹那韋與α-1-酸性糖蛋白(AAG)和白蛋白均可結合;但它與AAG的親和力更高。在穩態下,本品400/100 mg每日兩次給藥後,洛匹那韋的蛋白結合在觀察到的濃度範圍內保持恆定,健康志願者和HIV陽性患者之間情況相似。
代謝:
用人肝微粒體進行的體外實驗表明,洛匹那韋主要經氧化代謝。洛匹那韋被肝細胞色素P450系統廣泛代謝,且幾乎專門由CYP3A異構體代謝。利托那韋是一個強效的CYP3A抑制劑,可抑制洛匹那韋的代謝,因此能夠提高洛匹那韋的血漿濃度。一項人體14C-洛匹那韋研究表明,單次給予本品400/100 mg後,血漿放射活性的89%來自母體化合物。在人體中至少已鑑別出13個洛匹那韋的氧化代謝物。4-氧和4-氫氧代謝物異構體是具有抗病毒活性的主要代謝產物,但其血漿放射活性的存在時間很短,僅僅幾分鐘。實驗表明利托那韋能夠誘導代謝酶,從而誘導其自身的代謝,也可能誘導洛匹那韋的代謝。在多次給藥過程中,洛匹那韋在給藥前的濃度隨時間下降,約在10天至2周后達到穩定。
消除:
單劑量給予14C洛匹那韋利托那韋400/100mg後,在尿和糞便中檢測到的14C-洛匹那韋分別占給藥劑量的10.4±2.3%和82.6±2.5%。從尿和糞便中檢測的原形洛匹那韋分別約占給藥劑量的2.2%和19.8%。多次給藥後,以原形從尿中排泄的洛匹那韋不到給藥劑量的3%。超過12小時給藥間隔的洛匹那韋半衰期(從波峰到波谷)平均為5-6小時,洛匹那韋的表觀清除率為6-7l/h。
每日一次用藥:
本品每日一次用藥方法的藥代動力學研究已在未接受過抗反轉錄病毒藥物治療的患者中進行。每名患者服用本品800/200mg同時服用恩曲他濱200mg和替諾福韋DF 300mg每日一次。多次給予本品(800/200mg每日一次,無飲食限制,持續用藥2周),約在用藥6小時後洛匹那韋血藥濃度達峰,其峰值(C)為14.8±3.5μg/mL。清晨給藥前的平均穩態谷濃度為5.5±5.4μg/mL。超過24小時給藥間隔的洛匹那韋AUC為206.5±89.7μg·h/mL。
與每日兩次用藥方法相比,每日一次的用藥方法會使C/C值下降約50%。
特殊人群
兒童:
2歲以下兒童的藥代動力學數據有限。53名年齡在6個月至12歲的兒童患者參加了洛匹那韋利托那韋口服液300/75 mg/m2每日兩次和230/57.5 mg/m2 每日兩次的藥代動力學研究。在給予本品230/57.5 mg/m2 每日兩次(不給奈韋拉平)(n=12)或300/75 mg/m2每日兩次(給奈韋拉平)(n=12)後,洛匹那韋的平均穩態AUC值、Cmax和Cmin分別為72.6±31.1μgh/mL、8.2±2.9μg/mL、3.4±2.1μg/mL和85.8±36.9μgh/mL、10.0±3.3μg/mL、3.6±5.5μg/mL。230/57.5 mg/m2每日兩次(不給奈韋拉平)方案和300/75 mg/m2 每日兩次(給奈韋拉平)方案得到的洛匹那韋血漿濃度與在接受400/100 mg 每日兩次方案(不給奈韋拉平)的成年患者得到的血漿濃度相近。洛匹那韋利托那韋每日一次的用藥方法未在兒童患者中進行評估。
性別,種族和年齡:
尚未在老年患者中對本品的藥代動力學進行研究。成年患者未見與年齡或性別相關的藥代動力學差異。藥代動力學的種族差異尚未確定。
腎功能不全:
尚未在腎功能不全患者中進行洛匹那韋的藥代動力學研究;但是,因為洛匹那韋經腎臟的清除率微乎其微,因此腎功能不全患者不會發生總體清除率的下降。
肝功能不全:
在一項多劑量洛匹那韋利托那韋(400/100mg每日兩次)治療的研究中,比較了輕至中度肝功能不全與肝功能正常的HIV感染者的穩態藥代動力學參數。洛匹那韋總濃度會有約30%的小幅增加,但並無臨床相關性。
貯藏
室溫保存(低於30℃)。
包裝
高密度塑膠瓶裝,120片/瓶。
有效期
48個月,本品應在原始包裝中進行分發。如果該產品的原始包裝暴露在濕度過高的環境下超過2周,不建議患者服用。
執行標準
JX20070132
生產企業
AbbVie Deutschland GmbH & Co. KG
委託企業
AbbVie Ltd.
核准日期
2007年11月15日
修訂日期
2008年11月28日 2010年06月05日 2011年05月23日 2012年08月23日 2013年05月15日 2013年10月15日