概述
不典型主動脈縮窄症是指主動脈及其主要分支及肺動脈的慢性進行性非特異性炎變。以引起不同部位的狹窄或閉塞為主,少數病人因炎症破壞動脈壁的中層,而致動脈擴張或動脈瘤。因病變的部位不同,其臨床表現也不同。1908年日本眼科醫生高安首先發現1例21歲女性患者,其眼底視盤周圍有動靜脈吻合,1952年被Caccamise和Whitman命名為“高安病(Takayasu’s disease)”,但當時僅認為這是局限於主動脈弓及其分支的病,至於不典型主動脈狹窄和腎動脈狹窄則並不包含在Takayasu病的範圍內。病變發生在胸降主動脈者,則被稱為不典型(先天性)主動脈縮窄;在腎動脈者則可引起腎血管性高血壓;累及肺動脈者則可能產生肺動脈高壓;影響冠狀動脈可產生心絞痛或心肌梗死。本病常為多發性病變,表現一組特異病徵,黃宛和劉力生於1962年在國際上首先提出縮窄性不典型主動脈縮窄症的概念,取代了無脈病、主動脈弓綜合徵、不典型主動脈縮窄等含義不清的病名。由於少數患者可產生擴張性病變,因此,目前又統稱為不典型主動脈縮窄症。在局部症狀或體徵出現前數周,少數病人可有全身不適,易疲勞、發熱、食欲不振、噁心、出汗、體重下降和月經不調等症狀。當局部症狀或體徵出現後,全身症狀將逐漸減輕或消失。多數病人則無上述症狀。
疾病名稱
不典型主動脈縮窄症
英文名稱
Takayasu arteritis
別名
Takayasu’s disease;Takayasu病;大動脈炎;高安病;巨細胞必性動脈炎;突發性主動脈炎;無脈症;主動脈弓綜合徵;aorto-arteritis;高安氏病;縮窄性塔卡亞薩病;塔卡亞薩氏病;主動脈動脈炎;Takayasu's arteritis
ICD號:I73.8
普通外科 > 脈管疾病 > 動脈疾病
ICD號:I77.6
風濕科 > 瀰漫性結締組織病 > 血管炎與血管病
ICD號:I77.8
心血管內科 > 主動脈及大動脈疾病
I CD號:M31.8
皮膚科 > 皮膚血管病及淋巴管病
ICD號:N16.4*
腎內科 > 繼發性腎臟疾病 > 原發性系統性血管炎腎臟損害
流行病學
不典型主動脈縮窄症在亞洲地區,如日本、中國、韓國、印度、泰國等國家報導較多,其次是南美洲地區,如墨西哥、南非及前蘇聯歐洲地區,而西歐國家則罕見。在我國據有關文獻統計至少報導1300例,實際上遇到的不典型主動脈縮窄症患者則更多。男與女之比為l∶3.2。據日本全國統計不典型主動脈縮窄症患者約5000例,男與女之比為1∶10。1978年前蘇聯Pokrovsky報導235例不典型主動脈縮窄症,其中大部分來自前蘇聯歐洲地區。1992年韓國曾報導129例不典型主動脈縮窄症,以色列報導50例,1996年印度報導106例,泰國報導63例,土耳其14例,墨西哥報導292例,美國報導60例,可見本病於世界各地區均有發現,但其發病率有所不同。年齡最小為3歲,最大79歲,約90%在30歲以內發病。
病因
病因迄今尚不明確,曾有梅毒、動脈硬化、結核、血栓閉塞性脈管炎(Buerge病)、先天性異常、巨細胞動脈炎、結締組織病、風濕病、類風濕病、內分泌異常、代謝異常和自身免疫等因素有關。
發病機制
大動脈的發病機制有以下學說:
自身免疫學說
目前一般認為本病可能由於鏈球菌、結核菌、病毒或立克次體等感染後體內免疫過程所致。其表現特點:①血沉快;②血清蛋白電泳常見有7種球蛋白、a1及α2球蛋白增高;③“C”反應蛋白,抗鏈“O”及抗黏多糖酶異常;④膠原病與本病合併存在;⑤主動脈弓綜合徵與風濕性類風濕性主動脈炎相類似;⑥激素治療有明顯療效。但這些特點並非本病免疫學的可靠證據。血清抗主動脈抗體的滴度和抗體價均較其他疾病明顯增高,其主動脈抗原位於主動脈的中膜和外膜,血清免疫球蛋白示IgG、IgA和IgM均增高,以後二者增高為特徵。屍檢發現某些患者體內有活動性結核病變,其中多為主動脈周圍淋巴結結核性病變。Shimizt等認為可能由於此處病變直接波及主動脈或對結核性病變的一種過敏反應所致。顯微鏡檢查可見病變部位的動脈壁有新生肉芽腫和郎罕(Laghans)巨細胞,但屬非特異性炎變,未找到結核菌,而且結核病變極少侵犯血管系統。從臨床觀察來分析,大約22%患者合併結核病,其中主要是頸及縱隔淋巴結核或肺結核,用各種抗結核藥物治療。對不典型主動脈縮窄症無效,說明本病並非直接由結核菌感染所致。
內分泌異常
本病多見於年輕女性,故認為可能與內分泌因素有關。Numano等觀察女性不典型主動脈縮窄症患者在卵泡及黃體期24h尿標本,發現雌性激素的排泄量較健康婦女明顯增高。在家兔試驗中,長期套用雌激素後可在主動脈及其主要分支產生類似不典型主動脈縮窄症的病理改變。臨床上,大劑量套用雌性激素易損害血管壁,如前列腺癌患者服用此藥可使血管疾病及腦卒中的發生率增高。長期服用避孕藥可發生血栓形成的併發症。故Numano等認為雌性激素分泌過多與營養不良因素(結核)相結合可能為本病發病率高的原因。
遺傳因素
近幾年來,關於不典型主動脈縮窄症與遺傳的關係,引起某些學者的重視。Numano曾報導在日本已發現10對近親,如姐妹、母女等患有不典型主動脈縮窄症,特別是孿生姐妹患有此病,為純合子。在我國已發現一對孿生姐妹患有不典型主動脈縮窄症,另有兩對非孿生親姐妹臨床上符合不典型主動脈縮窄症的診斷,但每對中僅1例做了血管造影。我們曾對67例不典型主動脈縮窄症患者進行了HLA分析發現,A9、A10、A25、Awl9、A30、B5、B27、1340、B51、Bw60、DR7、DRw10、DQtw3出現頻率高,有統計學意義,但抗原不夠集中。日本曾對不典型主動脈縮窄症患者行HLA分析發現,A9、A10、B5、Bw40、Bw51、Bw52出現頻率高,特別是Bw52最高,並對124例患者隨訪20年發現,Bw52陽性者不典型主動脈縮窄症的炎症嚴重,需要激素劑量較大,並對激素有抗藥性;發生主動脈瓣關閉不全、心絞痛及心衰的併發症均較Bw52陰性者為重,提示HLA抗原基因不平衡具有重要的作用。
近來的研究發現,我國漢族不典型主動脈縮窄症患者與HLA-13R4,DR7等位基因明顯相關,DR7等位基因上游調控區核苷酸的變異可能和其發病與病情有關。發現DR4(+)或DR7(+)患者病變活動與動脈狹窄程度均較DR4(-)或DR7(-)者為重。Kitamura曾報導HLA-1352(+)較1352(-)者,主動脈瓣反流、缺血性心臟病、肺梗死等明顯為高,而腎動脈狹窄的發生率,則B39(+)較1339(-)者明顯增高。
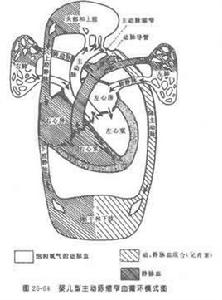
不典型主動脈縮窄症主要是累及彈力動脈,如主動脈及其主要分支、肺動脈及冠狀動脈,本病亦常累及肌性動脈。約84%患者病變侵犯2~13支動脈,其中以頭臂動脈(尤以左鎖骨下動脈)、腎動脈、腹主動脈及腸系膜上動脈為好發部位。腹主動脈伴有腎動脈受累者約占80%,單純腎動脈受累者占20%,單側與雙側受累相似。其次為腹腔動脈及髂動脈;肺動脈受累約占50%;近年發現冠狀動脈受累並不少見。
病理改變
本病系從動脈中層及外膜開始波及內膜的動脈壁全層病變,表現瀰漫性內膜纖維組織增生,呈廣泛而不規則的增生和變硬,管腔有不同程度的狹窄或閉塞,常合併血栓形成,病變以主動脈分支入口處較為嚴重。本病常呈多發性,在2個受累區之間常可見到正常組織區,呈跳躍性病變(skip lesion)。隨著病變的進展,正常組織區逐漸減少,在老年患者常合併有動脈粥樣硬化。近些年研究發現,本病引起動脈擴張性病變的發生率較前增高了,由於病變進展快,動脈壁的彈力纖維和平滑肌纖維遭受嚴重破壞或斷裂,而纖維化延遲和不足,動脈壁變薄,在局部血液動力學的影響下,引起動脈擴張或形成動脈瘤,多見於胸腹主動脈和右側頭臂動脈,以男性較為多見。Hotchi曾在82例屍檢中發現47例(57.3%)有動脈擴張、動脈瘤及動脈夾層,其中動脈擴張26例(31.7%),動脈瘤11例(13.4%),動脈瘤合併動脈擴張6例(7.3%),動脈夾層4例(4.9)%。肺動脈病變與主動脈基本相同,主要病變在中膜與外膜,內膜纖維性增厚是中膜與外膜炎變的繼發性反應,在肺動脈周圍分支幾乎均可見閉塞性病變,與支氣管動脈形成側支吻合。雙側彈性與肌性動脈受累後可提示有肺動脈高壓。
Nasu將不典型主動脈縮窄症病理分為3型,即肉芽腫型、瀰漫性炎變型、纖維化型。其中以纖維化型為主,並有逐漸增多趨勢。即使在纖維化型中,靠近陳舊病變處可見新的活動性病變。在屍檢中很難判定本病的初始炎變,根據研究有3種不同的炎變表現,即急性滲出、慢性非特異性炎變和肉芽腫,使受累區逐漸擴大。動脈中層常見散在灶性破壞,其間可有炎症肉芽組織和凝固性壞死,外膜中滋養血管的中層和外膜有明顯增厚,引起其管腔狹窄或閉塞;動脈各層均有以淋巴細胞和漿細胞為主的細胞浸潤,中層亦可見上皮樣細胞和朗罕巨細胞。電鏡所見:動脈壁平滑肌細胞細長,多充滿肌絲,細胞器很少;少數肌膜破壞,肌絲分解和消失,線粒體和內質網腫脹,空泡性變,以致細胞變空和解體;胞核不規則,染色質周邊性凝集,成纖維細胞少見,膠原纖維豐富,有局部溶解,網狀纖維少,彈力纖維有分布均勻、低電子密度的基質,以及疏鬆縱向走行的絲狀纖維。
不典型主動脈縮窄症通常累及主動脈弓和其主要分支,如頭臂動脈(尤其是鎖骨下動脈)、腎動脈、腹腔動脈、腸系膜上動脈、髂動脈、冠狀動脈及肺動脈等。病變有的可為多節段性的主動脈炎症,各病變節段之間的主動脈可正常;有的則可呈瀰漫性病變;有的則以主動脈某分支血管受累為主。病變85%表現為單純狹窄,2%表現為單純性擴張,13%表現為混合性的。冠狀動脈受累者40mm/h。前者可不用激素治療,後者則有套用指征。一般潑尼松(強的松)30mg一次/d頓服,維持4周后逐漸減量,每2~4周減少5~10mg,以後每2~4個月減少2.5mg,以血沉不增快為減量的指標,劑量減至每天10~5mg時,應維持一段時間。少數患者每天服用5mg達15~20年,病情穩定,未發現任何副作用,說明長期小劑量服用激素對控制病變活動是有幫助的。如用潑尼松無效,可改用地塞米松進行治療,地塞米松的抗炎作用較潑尼松更顯著。病情危重者可靜滴氫化可的松(氫化考的松)每天100mg,但合併結核或其他感染或惡性高血壓者,則不宜長時間套用激素。糖皮質激素長期大量使用時,可引起肥胖、多毛、水鈉瀦留、血糖升高、消化道潰瘍等副作用,而且長期大量套用激素有可能導致動脈壁變薄,故在選用激素治療時應權衡利弊,全面考慮。
還可試用免疫抑制劑硫唑嘌呤、環磷醯胺等。對於炎症反應重、血沉明顯增高、激素治療效果不佳的病人,應考慮加用免疫抑制劑。一般均與激素合用,可減少激素用量。但此法套用較少,效果尚難肯定。甲氨蝶呤(MTX)為葉酸拮抗劑,具有抑制免疫反應和抗炎效應,用法:2~5mg/d分2~3次口服,7~14天1個療程;或每周25~50mg,1次靜脈注射,顯效後減量為25~50mg/月。雷公滕多甙片,具有抗炎及免疫抑制作用,其效用與皮質激素相似,而無皮質激素的副作用。對皮質激素有耐藥性,或禁忌的不典型主動脈縮窄症患者可以其替代,當與皮質激素合用時可提高療效,減少激素的劑量及副作用。按每天每公斤體重1~1.5mg,分2~3次口服,長期服用應注意月經減少或閉經,白細胞減少。孕婦忌用。除按活動期治療外,伴有腦或肢體缺血表現者應並用擴張血管、改善微循環、抗血小板及抗高血壓等藥物進行治療。使用免疫抑制劑時需要注意:①長期套用可誘發嚴重感染,並有致癌、致畸作用,環磷醯胺可導致不孕;②宜與激素合用以增強療效,減輕副作用;③一般情況下宜首選皮質激素,如果療效不佳或不能耐受時則考慮合用或單用免疫抑制劑。
穩定期的治療
口服藥物可選用抗栓丸,每次2~3粒,3次/d;曲克蘆丁(維腦路通)0.2g~0.3g,3次/d;地巴唑20mg,3次/d;血管舒緩素(胰激肽釋放酶)60~120U,3次/d;羥乙基澱粉(706代血漿)250~500ml,加入川芎嗪靜滴120~160mg,1次/d,2~3周為一療程,可降低血漿黏稠度,減低紅細胞聚集,延長凝血時間。妥拉蘇林:25~50mg,3次/d口服。硝苯地平(心痛定):5~10mg,3次/d口服。己酮可可鹼:0.1~0.2g,3次/d口服,或0.1~0.2g,2次/d靜脈注射。川芎:具有擴張小動脈、抗血小板聚集等作用,用法:80mg加入5%的葡萄糖液250ml,1次/d,靜脈滴注,15天1療程。
阿司匹林50mg,1次/d;雙嘧達莫(潘生丁)25mg,3次/d。
藥物治療並非腎血管性高血壓的首選方法,僅對腎動脈成形術或外科手術禁忌者或拒絕接受上述治療者,採用藥物降壓治療,對一般降壓藥物反應不佳。目前討論最多的是血管緊張素轉換酶抑制劑治療腎血管性高血壓,對單側腎動脈狹動脈狹窄所致的腎素依賴性高血壓,在用其他降壓藥物無效時,可服用轉換酶抑制劑,有效地控制血壓,防止併發症,但此類藥物可降低狹窄側腎血流量,故服用時應監測腎臟功能改變。對雙側腎動脈狹窄或單功能腎(自然或人工移植)所致高血壓,對轉換酶抑制劑是絕對禁忌,並且療效也欠佳。
①卡托普利:12.5~25mg,3次/d口服,如效果不佳,1~2周后漸加至50~100mg,3次/d,口服,每天劑量不宜超過450mg。
②依那普利:作用較卡托普利強10倍,初始劑量10~20mg,1次/d,口服,最大劑量40mg/d。
β-受體阻滯藥,由於對腎素系統的抑制作用有限,降壓療效欠佳,應採用聯合用藥治療腎血管性高血壓,有人報導鈣拮抗藥與β-受體阻滯藥,如氨氯地平10mg;與阿替洛爾(氨醯心安)50mg合用有效。臨床上應結合具體病情與藥物反應,聯合用藥來控制血壓達到相應水平。
不典型主動脈縮窄症屬多發性病變,當累計鎖骨下動脈、胸腹主動脈、腎動脈、髂動脈或冠狀動脈產生明顯局限性狹窄,引起腦、心臟、肢體相應缺血時,有介入治療指征者,應首選介入治療,可獲得較好的療效。由於動脈擴張後再狹窄發生率較高,約20%~30%,故近幾年來,對腎動脈開口部狹窄,或伴有動脈夾層,或再狹窄的患者,主張在擴張的基礎上,植入支架可明顯減少再狹窄發生率。隨著介入技術的完善,介入療效不斷提高,該療法創傷小,併發症低,對於動脈局限性狹窄,可進行球囊導管擴張,或放置內支架,近期療效滿意。對發生動脈瘤的病人,可進行腔內支架人工血管置入術,遠期療效有待於評價。
藥物或介入治療無效,並有外科治療指征者,應採用手術治療,可解決或改善狹窄遠端缺血症狀,防止發生併發症。外科治療效果尚不能肯定,主要是針對受累血管狹窄或閉塞引起的腎血管性高血壓、腦缺血症狀、主動脈瘤和主動脈瓣返流及冠狀動脈狹窄等,採取切除局限性狹窄、內膜血栓切除、人工血管重建或冠狀動脈、腎動脈搭橋手術等。但外科手術在疾病活動期進行,危險性較大,必須待炎症控制後才能進行。經皮腔內血管成形術,為不典型主動脈縮窄症的治療開闢了一條新途徑。目前已成功地用於治療腎動脈狹窄、腹主動脈狹窄、頸動脈和鎖骨下動脈狹窄。
手術治療的原則是重建動脈,改善遠端血液供應。因多發性不典型主動脈縮窄症病變累及全層且與周圍組織粘連嚴重,甚至有廣泛鈣化,管壁病變部脆弱,直接手術滲血多,游離困難,組織不牢固,下針吻合、縫合不可靠,術後早晚期均有發生吻合口哆開,假性動脈瘤形成。因此,內膜摘除術、局部補片擴大管腔、切除移植術較少用。多採用病變遠、近端正常動脈旁路轉流術,手術一般不游離病變部,吻合口均在正常動脈組織,使手術簡化、安全效果較好,並可保留已建立的側支循環,療效滿意,是本病首選的手術方法。因手術系非解剖性轉流,手術方案的確定主要根據病變部位,患者全身情況,受累範圍而設計。一般在病變穩定後半年~1年後進行,臨床檢查包括體溫、紅細胞沉降率、白細胞計數、IgG均應正常。手術應在臟器(如腎臟)功能尚未消失時進行,以期改善血供維持功能。
當主動脈弓的分支發生多發性病變,特別是無名動脈及左頸總動脈和左鎖骨下動脈均被累及時,為改善腦或上肢的血供,做主動脈弓分支之間的旁路移植術已無濟於事,應行此術式。此術由De Bakey於1959年首先報導。根據病變部位、範圍有多種形式轉流術:升主動脈-頸總動脈或鎖骨下動脈旁路轉流、升主動脈-雙頸總動脈轉流等。
全身麻醉,氣管插管,仰臥位。取胸骨正中切口,再根據轉流情況向上延至頸部,或在頸部另做切口。牽開胸骨,切開心包,充分顯露升主動脈,主動脈弓及其分支。靜脈肝素化後,主動脈側壁鉗部分鉗閉升主動脈,按轉流血管直徑做縱行切口並行端一側吻合。另一端至頸總動脈或鎖骨下閉塞血管遠段做端-側吻合。多支病變可選用分叉血管或人造血管移植在血管橋上。徹底止血後,常規關閉胸部和頸部切口並行縱隔引流。
胸外途徑轉流術式手術創傷小,併發症少,手術死亡率低,術後效果滿意,臨床上較常套用。可採用自體靜脈或人造血管作移植材料。當有2支以上病變時可採用序貫轉流。常用術式如下:
A.鎖骨下動脈-頸總動脈旁路移植術:適用於頸總動脈或鎖骨下動脈起始部狹窄或閉塞者。全身麻醉,氣管插管,仰臥位。於鎖骨上做平行切口。切開皮膚、皮下組織和頸闊肌後橫斷胸鎖乳突肌,顯露脂肪墊、膈神經,在前斜角肌外側見鎖骨下動脈;分離牽引,保護好膈神經,注意勿損傷胸導管,顯露鎖骨下動脈;在其內側解剖脂肪墊游離出頸總動脈。靜脈肝素化後,阻斷頸總動脈,行自體靜脈或人造血管端-側吻合,開放阻斷鉗,排氣和驅除碎屑並阻斷移植血管,遠端與鎖骨下動脈端-側吻合。打最後一結時,鬆開阻斷鉗,排除氣和碎屑。創面依層縫合。
B.頸總動脈-頸總動脈轉流術:適用於無名動脈或左頸總動脈狹窄閉塞。在頸前鎖骨上做平行切口,按前述方法解剖游離左、右頸總動脈,移植入轉流血管。
C.腋動脈-腋動脈旁路移植術:適用於高齡、高危患者,可有效改善患側上肢缺血及椎動脈竊血。全身麻醉為宜,肩部墊高,上肢外展,在兩側鎖骨下2cm做平行切口顯露兩側腋動脈,於胸前切口間做皮下隧道置入移植血管,先行端-側縫合一側,再同法吻合另一側。
無名動脈、頸動脈、鎖骨下動脈有2支病變時,選用鎖骨下動脈-頸動脈-頸動脈、鎖骨下-鎖骨下-頸動脈序貫轉流術等。
A.腦栓塞:由於手術過程中阻斷動脈血栓形成或松鉗後,血栓、氣栓,碎屑等進入腦內動脈所致。因此,在阻斷動脈前需靜脈肝素化,充分排氣和碎屑後再開放阻斷鉗。B.腦缺血性損傷:由阻斷或牽拉頸總動脈時間過長所致。因此術前可行頸動脈壓迫實驗,增加腦缺血耐受能力。術中儘量減少阻斷時間,必要時在術中測量頸動脈遠端壓力,如>6.67kPa,常可耐受手術,如