單質簡介
碳在 地殼中的質量分數為0.027%,在 自然界中分布很廣。以化合物形式存在的碳有煤、石油、 天然氣、動植物體、 石灰石、 白雲石、二氧化碳等。
截止1998年底,在全球最大的化學文摘—— 美國化學文摘上登記的 化合物總數為18.8百萬種,其中絕大多數是碳的化合物。
眾所周知,生命的 基本單元 胺基酸、核苷酸是以碳 元素做骨架變化而來的。先是一節碳鏈一節碳鏈地接長,演變成為蛋白質和核酸;然後演化出原始的單細胞,又演化出蟲、魚、鳥、獸、猴子、猩猩、直至人類。這三四十億年的生命交響樂,它的主鏇律是碳的 化學演變。可以說,沒有碳,就沒有生命。碳,是生命世界的棟樑之材。
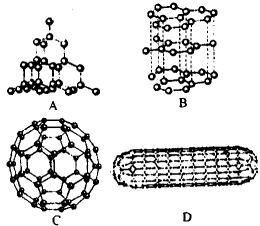
純淨的、 單質狀態的碳有三種,它們是 金剛石、石墨、C60。它們是碳的三種 同素異形體。
金剛石
金剛石晶瑩美麗,光彩奪目,是自然界最硬的礦石。在所有物質中,它的 硬度最大。測定物質 硬度的刻畫法規定,以 金剛石的硬度為10來度量其它物質的硬度。例如Cr的 硬度為9、Fe為4.5、Pb為1.5、鈉為0.4等。在所有 單質中,它的 熔點最高,達3823K。
金剛石晶體屬 立方晶系,是典型的 原子晶體,每個 碳原子都以sp3雜化軌道與另外四個 碳原子形成 共價鍵,構成 正四面體。這是金剛石的 面心立方晶胞的結構。
由於 金剛石晶體中C─C鍵很強,所有價電子都參與了 共價鍵的形成,晶體中沒有自由電子,所以金剛石不僅 硬度大, 熔點高,而且不導電。
室溫下, 金剛石對所有的化學試劑都顯 惰性,但在空氣中加熱到1100K左右時能燃燒成CO2。
金剛石俗稱鑽石,除用作裝飾品外,主要用於製造鑽探用的鑽頭和磨削工具,是重要的現代工業原料,價格十分昂貴。
石墨
石墨烏黑柔軟,是世界上最軟的 礦石。石墨的 密度比 金剛石小, 熔點比金剛石僅低50K,為3773K。
在石墨晶體中, 碳原子以sp2雜化軌道和鄰近的三個 碳原子形成 共價 單鍵,構成六角平面的 網狀結構,這些網狀結構又連成片層結構。層中每個 碳原子均剩餘一個未參加sp2雜化的p軌道,其中有一個未成對的p電子,同一層中這種碳原子中的m電子形成一個m中心m電子的大∏鍵(鍵)。這些 離域電子可以在整個兒 碳原子平面層中活動,所以石墨具有層向的良好導電導熱性質。
石墨的層與層之間是以 分子間力結合起來的,因此石墨容易沿著與層平行的方向滑動、裂開。石墨質軟具有潤滑性。
由於石墨層中有自由的電子存在,石墨的化學性質比 金剛石稍顯活潑。
由於 石墨能導電,有具有化學 惰性,耐高溫,易於成型和機械加工,所以石墨被大量用來製作 電極、高溫熱電偶、坩堝、電刷、潤滑劑和鉛筆芯。
碳六十
20世紀80年代中期,人們發現了碳 元素的第三種 同素異形體──C60。我們從以下三個方面介紹C60
1996年10月7日, 瑞典皇家科學院決定把1996年 諾貝爾化學獎授予Robert FCurl,Jr( 美國)、Harold WKroto( 英國)和Richard ESmalley(美國),以表彰他們發現C60。
1995年9月初,在美國 德克薩斯州Rice大學的Smalley實驗室里,Kroto等為了模擬N型紅巨星附近 大氣中的 碳原子簇的形成過程,進行了 石墨的雷射氣化實驗。他們從所得的質譜圖中發現存在一系列由 偶數個 碳原子所形成的分子,其中有一個比其它峰強度大20~25倍的峰,此峰的質量數對應於由60個碳原子所形成的分子。
C60分子是以什麼樣的結構而能穩定呢?層狀的石墨和 四面體結構的 金剛石是碳的兩種穩定存在形式,當60個 碳原子以它們中的任何一種形式排列時,都會存在許多懸鍵,就會非常活潑,就不會顯示出如此穩定的質譜信號。這就說明C60分子具有與 石墨和 金剛石完全不同的結構。由於受到建築學家Buckminster Fuller用五邊形和六邊形構成的拱形圓頂建築的啟發,Kroto等認為C60是由60個 碳原子組成的球形32面體,即由12個五邊形和20個六邊形組成,只有這樣C60分子才不存在懸鍵。
在C60分子中,每個 碳原子以sp2雜化軌道與相鄰的三個碳原子相連,剩餘的未參加雜化的一個p軌道在C60球殼的外圍和內腔形成 球面大∏鍵,從而具有芳香性。為了紀念Fuller,他們提出用Buckminsterfullerene來命名C60,後來又將包括C60在內的所有含偶數個碳所形成的分子通稱為Fuller,中譯名為 富勒烯
碳六十的製備
用純 石墨作 電極,在氦氣氛中放電,電弧中產生的 煙炱沉積在水冷反應器的內壁上,這種煙炱中存在著C60、C70等 碳原子簇的混合物。
用 萃取法從 煙炱中 分離提純 富勒烯,將煙炱放入索氏(Soxhlet)提取器中,用 甲苯或苯提取,提取液中的主要成分是C60和C70,以及少量C84和C78。再用液相色譜分離法對提取液進行分離,就能得到純淨的C60溶液。C60溶液是紫紅色的,蒸發掉溶劑就能得到深紅色的C60微晶。
碳六十的用途
從C60被發現的短短的十多年以來, 富勒烯已經廣泛地影響到物理學、化學、材料學、電子學、生物學、醫藥學各個領域,極大地豐富和提高了科學理論,同時也顯示出有巨大的潛在套用前景。
據報導,對C60分子進行摻雜,使C60分子在其籠內或籠外俘獲其它 原子或集團,形成類C60的 衍生物。例如C60F60,就是對C60分子充分氟化,給C60球面加上氟 原子,把C60球殼中的所有電子“鎖住”,使它們不與其它分子結合,因此C60F60表現出不容易粘在其它物質上,其潤滑性比C60要好,可做超級耐高溫的潤滑劑,被視為“分子滾珠”。再如,把K、Cs、Tl等金屬 原子摻進C60分子的籠內,就能使其具有超導性能。用這種材料製成的電機,只要很少電量就能使轉子不停地轉動。再有C60H60這些 相對分子質量很大地碳氫化合物熱值極高,可做火箭的 燃料。等等。
無定形碳
如 焦炭, 木炭, 活性炭和 炭黑。 活性炭疏鬆多孔,有很強的吸附能力,可作防毒口罩的濾毒層,或作防毒面具的濾毒罐、淨水過濾器; 炭黑 常溫下非常穩定,故用炭黑墨汁繪的畫和書寫的字經久不變色。
成鍵特徵
碳在 元素周期表中屬第ⅣA族頭一名元素,位於 非金屬性最強的鹵素元素和金屬性最強的鹼金屬之間。它的 價電子層結構為2s22p2,在 化學反應中它既不容易失去電子,也不容易得到電子,難以形成 離子鍵,而是形成特有的共價鍵,它的最高 共價數顯然為4。
碳原子sp3雜化
碳原子sp2雜化
碳原子sp雜化-1
碳原子sp雜化-2
碳原子sp3雜化
碳原子的sp3雜化可以生成4個σ鍵,形成正四面體構型。例如 金剛石、 甲烷CH4、四氯化碳CCl4、乙烷C2H6等。
在 甲烷分子中,C 原子4個sp3雜化軌道與4個H原子生成4個σ共價鍵,分子構型為 正四面體結構。
碳原子sp2雜化
碳原子的sp2雜化生成1個σ鍵,2個∏鍵,平面三角形構型。例如石墨、COCl2、C2H4、C6H6等。
在COCl2分子中,C 原子以3個sp2雜化軌道分別與2個Cl原子和1個O原子各生成1個σ 共價鍵外,它的未參加雜化的那個p軌道中的未成對的p電子O原子中的對稱性相同的1個p軌道上的p電子生成了一個∏共價鍵,所以在C和O原子之間是共價雙鍵,分子構型為平面三角形。
碳原子sp雜化-1
生成2個 σ鍵,未雜化軌道生成2個Π鍵,直線形構型。例如CO2、HCN、C2H2等。
在CO2分子中,C 原子以2個sp 雜化軌道分別與2個O原子生成2個σ 共價鍵,它的2個未參加雜化的p軌道上的2個p電子分別與2個O原子的對稱性相同的2個P軌道上的3個p電子形成2個三中心四電子的大∏鍵,所以CO2是2個雙鍵。
在HCN分子中,C 原子分別與H和N原子各生成1個σ 共價鍵外,還與N原子生成了2個正常的∏共價鍵,所以在HCN分子中是一個單鍵,1個叄鍵。
碳原子sp雜化-2
生成1個 σ鍵,1個∏鍵,未雜化軌道生成1個配位∏鍵和1對 孤對電子對,直線型構型。例如在CO分子中,C 原子與O原子除了生成一個σ 共價鍵和1個正常的∏共價鍵外,C原子的未參加雜化的1個空的p軌道可以接受來自O原子的一對 孤電子對而形成一個配位∏鍵,所以CO分子中C與O之間是叄鍵,還有1對孤電子對。
碳原子不僅僅可以形成 單鍵、 雙鍵和叄鍵,碳原子之間還可以形成長長的直鏈、環形鏈、支鏈等等。縱橫交錯,變幻無窮,再配合上氫、氧、硫、磷、和金屬 原子,就構成了種類繁多的碳化合物。