基本內容
硝酸鹽是硝酸根離子NO₃−形成的鹽。許多金屬都能形成硝酸鹽,包括無水鹽或水合物。
簡介
硝酸根(nitrate)
1.定義:一般地,硝酸根是指硝酸鹽的陰離子.
 硝酸根
硝酸根2.化學式:NO
,硝酸根為-1價,其中N為最高價+5價
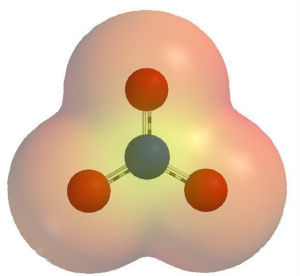
3.結構式: :O=NO
4.離子結構: N原子以sp2雜化軌道成鍵、離子中存在3個σ鍵,離子為平面三角形。
5.氧化性離子:
硝酸根在酸性環境下顯強氧化性:
例如硝酸和銅反應:
Cu+4HNO(濃)=Cu(NO)+2NO↑+2HO
3Cu+8HNO3(稀)=3Cu(NO)+2NO↑+4HO
硝酸與非金屬反應
 硝酸根
硝酸根C+4HNO(濃)
CO↑+4NO↑+2HO
 硝酸根
硝酸根S+4HNO(濃)
SO↑+4NO↑+2HO
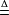 硝酸根
硝酸根P+5HNO(濃)
HPO+5NO↑+HO
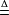 硝酸根
硝酸根3P+5HNO(稀)+2HO
=3HPO+5NO↑
相對分子質量:62
檢驗
目的:認
 1
1識檢驗硝酸根離子的方法。
用品:試管、試管架、試管夾、量筒。
硝酸鉀、硫酸亞鐵、濃硫酸。
原理:硝酸根離子有氧化性,在酸性溶液中能使亞鐵離子氧化成鐵離子,而自己則還原為一氧化氮。一氧化氮能跟許多金屬鹽結合生成不穩定的亞硝基化合物。它跟硫酸亞鐵反應即生成深棕色的硫酸亞硝基鐵:
3Fe2++NO3-+4H+=3Fe3++2H2O+NO
FeSO4+NO=Fe(NO)SO4
實驗室里常利用這個反應檢驗硝酸根離子,稱為棕色環試驗。這種簡單亞硝基化合物只存在於溶液內,加熱時,一氧化氮即從溶液內完全逸出。
亞硝酸根離子也能發生類似的反應。要區別這兩種酸根離子可以用濃磷酸,亞硝酸根離子能顯現深棕色而硝酸根離子卻不能。
準備和操作:往試管里注入3毫升1摩/升的硝酸鉀溶液和3毫升1摩/升的硫酸亞鐵溶液,振盪試管,混和均勻。斜持試管,沿試管壁慢慢注入濃硫酸3毫升,使密度較大的濃硫酸沉入試管的底部,跟硝酸鉀和硫酸亞鐵的混和溶液分成兩層。稍待片刻,把試管慢慢豎直,不久,兩層液體間就有一個棕色的環生成。
注意事項:硫酸亞鐵必須是新製備的,硫酸必須是濃的。操作時不能把溶液沖渾。
其它實驗方法:適用於固態的硝酸鹽或相當濃的硝酸鹽溶液。把少量的硝酸鹽晶體或濃溶液置於試管內,然後加入少量濃硫酸(1∶1)。再向試管內加入一小塊銅片。給試管加熱,有紅棕色氣體產生,則證明含有硝酸根離子。
Cu+2NO3-+2H2SO4=CuSO4+2NO2↑+2H2O+SO42-
儀器測定
測量原理是依據NO發色團在210-220nm強紫外光下的吸收反應,再使用朗伯—比爾定律換算:
[C]=Klog(I in/I out )
[C]:樣品濃度
K:吸收係數
用途
硝酸銀實驗室中用於檢驗氯離子,因為銀離子和氯離子能結合不溶於酸的白色沉澱氯化銀。一般還與稀硝酸配合用於檢驗。在有機化學中,硝酸根可以用於生成硝酸酯(RONO2),比如鹵代烴與硝酸銀反應就可以生成鹵化銀沉澱和硝酸酯。
硝酸鈉常見的化肥
硝酸銨(NH₄NO₃)簡稱硝銨,常見的化肥
硝酸鉀常見的複合肥料