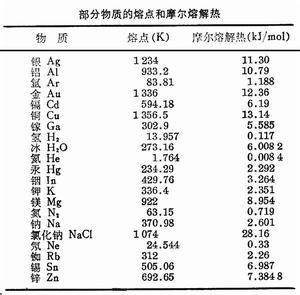
熔解熱
正文
在晶體中,粒子之間的相互作用力使粒子規則地聚集在一起,形成空間點陣,粒子只能在它的平衡位置附近作微小振動。熔解過程中吸收的熱量(熔解熱),從微觀上看,就是外界給粒子提供能量,使它的熱振動加劇,直至粒子之間的引力再不能維持它的有序排列,而逐漸轉向無序,熔解為液體。可見,對於晶體,熔解熱就是破壞晶體點陣結構所需要的能量,因此熔解熱可以用來衡量晶體內聚能的大小。利用克拉珀龍方程可以求得熔點隨壓強的改變、以及熔解熱隨溫度的改變等。一般來說,物質的熔點隨壓強的改變是不顯著的,熔解熱與壓強基本無關。
熔解熱和結晶熱在數值上相等,但在熱力學計算式中結晶熱前需冠以負號。
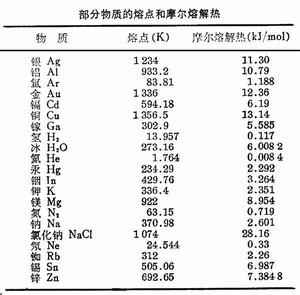 熔解熱
熔解熱