形態
氟銻酸或稱六氟銻酸、六氟合銻酸,化學式為HSbF,是氫氟酸和電子酸五氟化銻反應後的產物.以一比一的比例混合時成為已知最強的超強酸,實驗證明能分解碳氫化合物,產生碳正離子以及氫氣。
 氟銻酸
氟銻酸氫氟酸(HF)和五氟化銻(SbF)互相反應強烈放熱.HF會釋放質子H ,然後氟離子F 會與SbF形成八面體型的SbF 陰離子。SbF 是非配位陰離子,親核性和鹼性都很弱.於是質子實際上是“裸露”在溶液中,使得混合物體系呈現超強的酸性,比純硫酸要強2×10 倍。該酸必須用特氟龍(聚四氟乙烯)材料裝盛。
圖右為氟銻酸的3D分子球棍模型。
結構
用X射線晶體學研究兩份HF-SbF5反應形成的結晶,發現化學式分別為[H2F][Sb2F11]和[H3F2][Sb2F11],都含有Sb2F11作陰離子。據估計,Sb2F11離子的鹼性比SbF6還要弱,因此更加穩定。
酸度對照
以下的資料是以哈米特酸度函式作為依據,酸度以大負數H0值表示:
氟銻酸【1:1】(1990)(H0值= -28)
魔酸【1:1】(1974)H0值= -25)
碳硼烷酸(2004)(H0值= -18.0)
氟硫酸(1944)(H0值=-15.6)
三氟甲磺酸(1940)(H0值=-14.6)
高氯酸(H0值=-13)
純硫酸(H0值=-11.93)
註:碳硼烷酸是 單一分子酸中酸性最強的酸,而非酸性最強的酸。
六氟銻酸是超強酸 體系,而非 化合物。
套用
氟銻酸使其幾乎可以質子化所有的有機化合物.它與異丁烷和新戊烷反應會生成相應的碳正離子:
(CH)CH + H → (CH)C + H;
(CH)C + H → (CH)C + CH
1、使某些很難質子化的物質(如高氯酸)質子化,進一步製備含有-ClO3基團的有機物:
HClO + H ==== [HClO]
[H2ClO4]+ +H+ ====[ClO3]++ [H3O]+
C6H6 + [ClO3]+ ==== [C6H6ClO3]+
[C6H6ClO3]+ - H+ ====C6H5ClO3
2、使高級烷烴質子化,催化烷烴裂解:
(CH3)3CH + H → (CH3)3C + H2;
(CH3)4C + H → (CH3)3C + CH4
3、含有羥基的有機物(如醇、酚、羧酸等)質子化,進一步脫羥基化。
R-OH + 2H = R+(碳正離子) + [HO]
4、強氧化劑:Sb(Ⅵ)氟化物例如SbF具有很強的氧化性,能夠氧化多種金屬及還原劑。
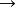 氟銻酸
氟銻酸 氟銻酸
氟銻酸5,配位性:Au+HSbFAu +Sb +HF
要注意的是,氟銻酸是無水體系,當氟銻酸與大量水混合時發生強烈反應,氫離子(質子)被中和生成水合氫離子,不再具有超酸性。
反應方程式:H +HO=HO
危險性
氟銻酸會與水發生強烈反應甚至爆炸,若溶劑為水,則與其他酸的強度無法區分。 盛氟銻酸的容器必須用特氟龍(即聚四氟乙烯)的材料盛裝,其他塑膠會被嚴重腐蝕。
性狀:
1、沸點:無(注意,混合物無固定沸點)
2、熔點:無(注意,混合物無固定熔點)
3、氟銻酸中均不含水,SbF為溶劑,H2SbF7及HF是溶質。故氟銻酸均為無色油狀液體。
4、氧化性:因為其中含有五價銻,所以氧化性非常強。

