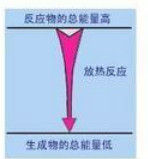
解釋
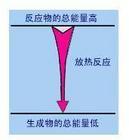 化學上把有熱量放出的化學反應叫做放熱反應
化學上把有熱量放出的化學反應叫做放熱反應反應類型
燃燒、中和、金屬氧化、鋁熱反應、較活潑的金屬與酸反應、由不穩定物質變為穩定物質的反應多數化合反應是放熱的(但是我們要注意高壓下石墨轉變成金剛石也是放熱反應,儘管常壓下是相反的),多數分解反應是吸熱的(但均不能絕對化,如氯酸鉀分解生成氯化鉀與氧氣就是常見的放熱反應)能自發進行的氧化還原反應都是放熱反應,常見反應中燃燒反應、中和反應全是放熱反應,酸鹼中和的反應,金屬與酸的反應,金屬與水的反應,燃燒反應,爆炸反應全是放熱反應,在具體判斷中往往要結合記憶中的事實來進行。放熱反應的逆反應一定是吸熱反應。相關信息
是否放熱主要是看反應物的總能是否大於生成物的總能:反應物的總能量大於生成物,放熱
反應物的總能量小於生成物,吸熱
放熱反應在常溫下不一定能發生,例如氮氣與氫氣的反應還有水和氫氧化鈉
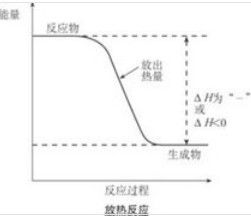 放熱反應的反應物和生成物的總能量相對大小
放熱反應的反應物和生成物的總能量相對大小也不能發生反應.
當然也能從純理論上來進行計算,但需要運用大學裡才會學到的化學熱力學知識,並要求能查到一些常數。運用中學裡學到的鍵能的數據也能計算,不過這種做法在解題實戰中意義不大。
放熱反應的巨觀表現是溫度升高,微觀表現是生成物的總能量相對較大。
C2H5OH+3O2點燃2CO2+3H2O
2CO+O2點燃2CO2
2C+O2點燃2CO
Mg+H2SO4=MgSO4+H2↑(這是放熱的)
Fe2O3+3H2Δ2Fe+3H2O
Fe3O4+4H2Δ3Fe+4H2O
WO3+3H2ΔW+3H2O
MoO3+3H2ΔMo+3H2O
2Na+Cl2Δ或點燃2NaCl
H2+Cl2點燃或光照2HCl
C+2CuO高溫2Cu+CO2↑
2Fe2O3+3C高溫4Fe+3CO2↑
Fe3O4+2C高溫3Fe+2CO2↑
CuO+COΔCu+CO2
CaO+H₂O=Ca(OH)₂
常見反應
(1)所有燃燒或爆炸反應。(2)酸鹼中和反應。
(3)多數化合反應。
(4)活潑金屬與水或酸生成H2的反應。
(5)大部分氧化還原反應。
(6)NaOH或濃硫酸溶於水(註:這兩點只是說會放熱,但嚴格說起來並不算化學反應,考試時應注意)
(7)CaO與水反應生成Ca(OH)2,這也就是為什麼生活常識中說生石灰不能加水,不能入眼