簡介
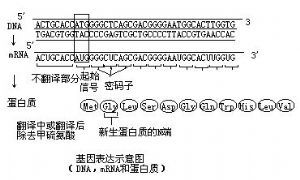 基因表現示意圖
基因表現示意圖 又稱基因表達,有時直接以表現或表達來稱呼)細胞在生命過程中,把儲存在DNA順序中遺傳信息經過轉錄和翻譯,轉變成具有生物活性的蛋白質分子。生物體內的各種功能蛋白質和酶都是同相應的結構基因編碼的。差別基因表達(differentialgeneexpression)指細胞分化過程中,奢侈基因按一定順序表達,表達的基因數約占基因總數的5%~10%。也就是說,某些特定奢侈基因表達的結果生成一種類型的分化細胞,另一組奢侈基因表達的結果導致出現另一類型的分化細胞,這就是基因的差別表達。其本質是開放某些基因,關閉某些基因,導致細胞的分化。 在特定時間裡,很大一部分DNA並不轉錄成信使RNA,細胞只生產那些代謝需要的酶和其他蛋白質。生物體有決定哪些基因表達,哪些基因不表達的整套調節機制,這是生物生長和分化的基礎。基因工程就是研究基因在異體中表達的技術。
轉錄
基因表現的第一步是轉錄,在RNA聚合酶的催化下,以DNA為模板合成mRNA的過程稱為轉錄(transcription).在雙鏈DNA中,作為轉錄模板的鏈稱為模板鏈(template strand),或反義鏈(antisensestrand);而不作為轉錄模板的鏈稱為編碼鏈(coding strand),或有義鏈(sense strand).在雙鏈DNA中與轉錄模板互補的一條DNA鏈即編碼鏈,它與轉錄產物的差異僅在於DNA中T變為RNA中的U.在含許多基因的DNA雙鏈中,每個基因的模板鏈並不總是在同一條鏈上,亦即一條鏈可作為某些基因的模板鏈的,也可是另外一些基因的編碼,轉錄後要進行加工,轉錄後的加工包括:
剪接
 基因表現
基因表現 一個基因的外顯子和內含子都轉錄在一條原始轉錄物RNA分子中,稱為前mRNA(pre-mRNA),又稱核內異質RNA(heterogenuous nuclear RNA,huRNA)。因此前mRNA分子既有外顯子順序又有內含子順序,另外還包括編碼區前面及後面非翻譯順序。這些內含子順序必須除支而把外顯子順序連線起來,才能產生成熟的有功能的mRNA分子,這個過程稱為RNA剪接(RNa splicing)。剪下發生在外顯子的3’末端的GT和內含子3’末端與下一個外顯子交界的AG處。
加帽
幾乎全部的真核 mRNa 端都具“帽子”結構。雖然真核生物的mRNA的轉錄以嘌呤核苷酸三磷酸(pppAG或pppG)領頭,但在5’端的一個核苷酸總是7-甲基鳥核苷三磷酸(m7GpppAGpNp)。mNRA5’端的這種結構稱為帽子(cap)。不同真核生物的mRNA具有不同的帽子。 mRNA的帽結構功能:①能被核糖體小亞基識別,促使mRNA和核糖體的結合;②m7Gppp結構能有效地封閉RNa 5’末端,以保護mRNA免疫5’核酸外切酶的降解,增強mRNA的穩定
加尾
大多數真核生物的mRNA 3’末端都有由100~200個A組成的Poly(A)尾巴。Poly(A)尾不是由DNA編碼的,而是轉錄後的前mRNA以ATP為前體,由RNA末端腺苷酸轉移酶,即Ploy(A)聚合酶催化聚合到3’末端。加尾並非加在轉錄終止的3’末端,而是在轉錄產物的3’末端,由一個特異性酶識別切點上遊方向13~20鹼基的加尾識別信號AAUAAA以及切點下游的保守順序GUGUGUG,把切點下游的一段切除,然後再由Poly(A)聚合酶催化,加上Poly(A)尾巴,如果這一識別信號發生突變,則切除作用和多聚腺苷酸化作用均顯著降低。mRNAPoly(A)尾的功能是:①可能有助mRNA從核到細胞質轉運;②避免在細胞中受到核酶降解,增強mRNA的穩定性。
翻譯
以mRNA作為模板,tRNA作為運載工具,在有關酶、輔助因子和能量的作用下將活化的胺基酸在核糖體(亦稱核蛋白體)上裝配為蛋白質多肽鏈的過程,稱為翻譯(translation),這一過程大致可分為3個階段:
(1)肽鏈的起始:在許多起始因子的作用下,首先是核糖體的小亞基和mRNA上的起始密碼子結合,然後甲醯甲硫氨醯tRNA(tRNA fMet)結合上去,構成起始複合物。通過tRNA的反密碼子UAC,識別mRNA上的起始密碼子AUG,並相互配對,隨後核糖體大亞基結合到小亞基上去,形成穩定的複合體,從而完成了起始的作用。
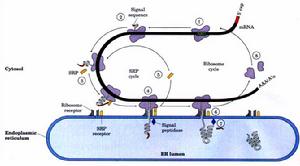 蛋白翻譯
蛋白翻譯 肽鏈的延和長
核糖體上有兩個結合點——P位和A位,可以同時結合兩個氨醯tRNA。當核糖體沿著mRNA從5’→3’移動時,便依次讀出密碼子。首先是tRNAfMet結合在P位,隨後第二個氨醯tRNA進入A位。此時,在肽基轉移酶的催化下,P位和A位上的2個胺基酸之間形成肽鍵。第一個tRNA失去了所攜帶的胺基酸而從P位脫落,P位空載。A位上的氨醯tRNA在移位酶和GTP的作用下,移到P位,A位則空載。核糖體沿mRNA 5’端向3’端移動一個密碼子的距離。第三個氨醯tRNA進入A位,與P位上胺基酸再形成肽鍵,並接受P位上的肽鏈,P位上tRNA釋放,A位上肽鏈又移到P位,如此反覆進行,肽鏈不斷延長,直到mRNA的終止密碼出現時,沒有一個氨醯tRNA可與它結合,於是肽鏈延長終止。
肽鏈的終止
終止信號是mRNA上的終止密碼子(UAA、UAG或UGA)。當核糖體沿著mRNA移動時,多肽鏈不斷延長,到A位上出現終止信號後,就不再有任何氨醯tRNA接上去,多肽鏈的合成就進入終止階段。在釋放因子的作用下,肽醯tRNA的的酯鍵分開,於是完整的多肽鏈和核糖體的大亞基便釋放出來,然後小亞基也脫離mRNA。
翻譯後加工
從核糖體上釋放出來的多肽需要進一步加工修飾才能形成具有生物活性的蛋白質。翻譯後的肽鏈加工包括肽鏈切斷,某些胺基酸的羥基化、磷酸化、乙醯化、糖基化等。真核生物在新生手肽鏈翻譯後將甲硫氨酸裂解掉。有一類基因的翻譯產物前體含有多種胺基酸順序,可以切斷為不同的蛋白質或肽,稱為多蛋白質(polyprotein)。例如胰島素(insulin)是先合成86個胺基酸的初級翻譯產物,稱為胰島素原(proinsulin),胰島素原包括A、B、C三段,經過加工,切去其中無活性的C肽段,並在A肽和B肽之間形成二硫鍵,這樣才得到由51個胺基酸組成的有活性的胰島素。
外顯子
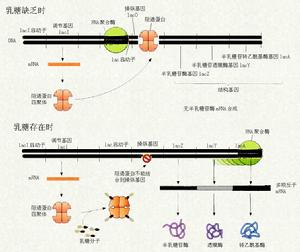 基因表現的調控
基因表現的調控 外顯子與內含子表達過程中的相對性 從內含子與外顯子的定義來看,兩者是不能混淆的,但是真核生物的外顯子也並非都“顯”(編碼胺基酸),除了tRNA基因和rRNA基因的外顯子完全“不顯”之外,幾乎全部的結構基因的首尾兩外顯子都只有部分核苷酸順序編碼胺基酸,還有完全不編碼基酸的外顯子,如人類G6PD基因的第一外顯子核苷酸順序。現在已發現一個基因的外顯子可以是另一基因的內含子,所這亦然。以小鼠的澱粉酶基因為例,來源於肝的與來源於唾液腺的是同一基因。澱粉酶基因包括4個外顯子,肝生成的澱粉酶不保留外顯子1,而唾液腺中的澱粉酶則保留了外顯子1的50bp順序,但把外顯子2與前後兩段內含子一起剪下掉,經過這樣剪接,外顯子2就變成唾液澱粉酶基因中的內含子。
同一基因在不同組織能生成不同的基因產物來源於不同組織的類似蛋白,可以由同一基因編碼產生,這種現象首先是由於基因中的增強子等有組織特異性,它能與不同組織中的組織特異因子結合,故在不同組織中同一基因會產生不同的轉錄物與轉錄後加工作用。此外真核生物基因可有一個以一的poly(A)位點,因此能在不同的細胞中產生具有不同3’末端的前mRNA,從而會有不同的剪接方式。由於大多數真核生物基因的轉錄物是先加poly(A)尾巴,然後再行剪接,因此不同組織、細胞中會有不同的因子干預多聚腺苷酸化作用,最後影響剪接模式。
實驗套用
利用基因晶片研究乾旱脅迫下玉米基因表達
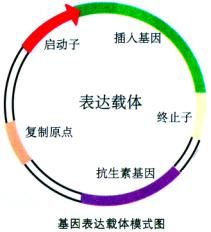 基因表達載體的構建(基因工程的核心)
基因表達載體的構建(基因工程的核心) 玉米是全球第一大作物、中國第二大作物,而乾旱是影響其產量的重要限制因素。山東大學生命科學院張舉仁教授的課題組利用基因晶片技術研究了開花期玉米頂葉乾旱脅迫下基因的表達。開花期是玉米需水臨界期,對乾旱脅迫反應最敏感,此時逢乾旱會使產量下降幅度最大。張教授的課題組以開花期玉米為材料,分別對其進行短期和長期的乾旱脅迫,採用全基因組晶片研究了頂葉中基因的表達情況。分析的結果表明,有197個基因在短期脅迫下差異表達(53%上調),而在長期脅迫下,則有1009個基因差異表達(32%上調)。分離得到的差異表達基因中約有一半的基因功能未知,其他基因按功能則可分為:代謝相關;細胞信號轉導;轉錄相關;蛋白質合成;細胞防禦;細胞運輸;亞細胞定位等幾大類。分析實驗表明,在短期脅迫下上調錶達的基因中,約有1/3的已知功能基因屬於信號轉導功能的分類範疇,參與細胞內不同的信號轉導途徑,這表明信號轉導相關基因在玉米對乾旱的早期反應中起重要作用。而在長期乾旱條件下,頂葉中大量的代謝相關基因差異表達。
有助於肺癌的早期診斷
在全世界癌症患者的死亡率中,肺癌的死亡率位居前列。肺癌高死亡率的主要原因之一是缺乏早期診斷工具。研究人員在3月出版的《自然—醫學》中報導:吸菸者肺細胞的基因表達模式也許有助於肺癌的早期診斷。
眾所周知,吸菸是肺癌的風險因子,因此吸菸者被認為是肺癌的高風險人群。吸菸者的正常上皮細胞的基因表達模型是否可用於肺癌存在狀態的一種生物標誌呢?AvrumSpira和同事進行了這一研究。在預測患者是否會向癌症發展時,他們研究的生物標誌的準確率達到90%。當與其他歷史數據結合在一起,準確率可增加到95%。
研究進展
Mdk是一種分泌型蛋白,在神經發育中有重要作用,並參與人類腫瘤的形成。但是,在不同種類的脊椎動物中,Mdk基因的表達模式卻大相逕庭。該文報導了從銀鯽10體節胚胎的SMARTcDNA文庫中克隆的銀鯽Mdkb基因的特徵、表達圖式及功能。在銀鯽胚胎髮育過程中,CagMdkb基因在原腸期開始表達,在10體節期時表達量上升到最高,此後表達量保持穩定。Western印跡顯示胚胎早期有一條19kDa的母源CagMdkb蛋白帶,合子CagMdkb蛋白從原腸期開始產生。大約在10體節時,19kDa的CagMdkb蛋白剪掉了信號肽,變成17kDa的成熟蛋白。在胚胎髮育早期,母源的CagMdkb蛋白在所有卵裂球的細胞質中被檢測到。
當胚胎髮育到18體節期時,新合成蛋白的信號出現在後腦的一對巨大神經元中。此後,新合成的CagMdkb蛋白延伸到前腦、中腦、後腦的神經元和脊髓的神經纖維中。3A10抗體共定位表明這對巨大的神經元是Mauthner神經元。在銀鯽和斑馬魚受精卵中進行的基因轉移實驗發現,野生型CagMdkbRNAs的過量表達造成了胚胎前腦組織和眼睛發育受到抑制等嚴重缺陷,並發現其功能的發揮還依賴於它的分泌特性。上述結果表明,CagMdkb在魚類神經系統的早期發育中起著重要作用。
基因表達調控
從DNA到蛋白質的過程叫基因表達(gene expression),對這個過程的調節即為基因表達調控(regulation of gene expression or gene control)。基因調控是現代分子生物學研究的中心課題之一。因為要了解動植物生長發育規律。形態結構特徵及生物學功能,就必須搞清楚基因表達調控的時間和空間概念,掌握了基因調控機制,就等於掌握了一把揭示生物學奧秘的鑰匙。基因表達調控主要表現在以下幾個方面:① 轉錄水平上的調控;② mRNA加工、成熟水平上的調控;③ 翻譯水平上的調控;
基因表達調控的指揮系統有很多種,不同生物使用不同的信號來指揮基因調控。原核生物和真核生物之間存在著相當大差異。原核生物中,營養狀況、環境因素對基因表達起著十分重要的作用;而真核生物尤其是高等真核生物中,激素水平、發育階段等是基因表達調控的主要手段,營養和環境因素的影響則為次要因素。
原核生物的基因表達調控
原核生物的基因表達調控雖然比真核生物簡單,然而也存在著複雜的調控系統,如在轉錄調控種就存在著許多問題:如何在複雜的基因組內確定正確的轉錄起始點?如何將DNA的核苷酸按著遺傳密碼的程式轉錄到新生的RNA鏈中?如何保證合成一條完整的RNA鏈?如何確定轉錄的終止?
上述問題決定於DNA的結構、RNA聚合酶的功能、蛋白因子及其他小分子配基的互相作用,在轉錄調控中,現已搞清楚了細菌的幾個操縱子模型,現以乳糖操縱子和色氨酸操縱子為例予以說明。
真核生物基因表達調控
真核生物基因表達調控與原核生物有很大的差異。原核生物同一群體的每個細胞都和外界環境直接接觸,它們主要通過轉錄調控,以開啟或關閉某些基因的表達來適應環境條件(主要是營養水平的變化),故環境因子往往是調控的誘導物。而大多數真核生物,基因表達調控最明顯的特徵時能在特定時間和特定的細胞中激活特定的基因,從而實現“預定”的,有序的,不可逆的分化和發育過程,並使生物的組織和器官在一定的環境條件範圍內保持正常的生理功能。真核生物基因表達調控據其性質可分為兩大類:第一類是瞬時調控或叫可逆調控,相當於原核生物對環境條件變化所做出的反應。瞬時調控包括某種代謝底物濃度或激素水平升降時及細胞周期在不同階段中酶活性和濃度調節。第二類是發育調節或稱不可逆調控,這是真核生物基因表達調控的精髓,因為它決定了真核生物細胞分化,生長,和發育的全過程。據基因調控在同一時間中發生的先後次序,又可將其分為轉錄水平調控,轉錄後的水平調控,翻譯水平調控及蛋白質加工水平的調控,研究基因調控應回答下面三個主要問題:①什麼是誘發基因轉錄的信號? ②基因調控主要是在那個環節(模板DNA轉錄,mRNA的成熟或蛋白質合成)實現的?③不同水平基因調控的分子機制是什麼?
回答上述這三個問題是相當困難的,這是因為真核細胞基因組DNA含量比原核細胞多,而且在染色體上除DNA外還含有蛋白質,RNA等,在真核細胞中,轉錄和翻譯兩個過程分別是在兩個彼此分開的區域:細胞核和細胞質中進行。 一條成熟的mRNA鏈只能翻譯出一條多肽鏈;真核細胞DNA與組蛋白及大量非組蛋白相結合,只有小部分DNA是裸露的;而且高等真核細胞內DNA中很大部分是不轉錄的;真核生物能夠有序的根據生長發育階段的需要進行DNA片段重排,並能根據需要增加細胞內某些基因的拷貝數等。儘管難度很大,科學家們還是建立起多個調控模型。