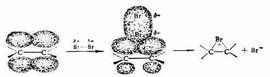
簡介
 親電加成
親電加成不飽和烴都含有π鍵。如烯烴分子中π軌道處於雙鍵的上方和下方,π電子是裸露的,易於受親電試劑的攻擊
。
親電試劑
親電試劑(Electrophile)在進攻反應中心時,試劑的正電部分較活潑,總是先加在反應中心電子云密度大的原子上,即電子云密度較大的雙鍵碳上。常見的親電試劑有鹵素(Cl2、Br2),無機酸(H2SO4、HCl、HBr、Hl、HOCl、HOBr),有機酸(F3C—COOH、CI3C—COOH)等。
親電加成反應
不飽和烴受親電試劑進攻後,π鍵斷裂,試劑的兩部分分別加到重鍵兩端的碳原子上。
有機化學中的概念,對進攻試劑而言,如果是獲取電子傾向強烈的,如鹵素、氯化氫(中的H+)等,與烯、炔加成反應時,先是由親電的部分(H+、X+)進攻多電子的烯、炔的重鍵,稱親電加成。
親電加成反應(EA)
簡稱親電加成,是親電試劑(帶正電的基團)進攻不飽和鍵引起的加成反應。反應中,不飽和鍵(雙鍵或三鍵)打開,並與另一個底物形成兩個新的σ鍵。反應分兩步進行:
第一步
親電試劑對雙鍵進攻形成碳正離子。
第二步
親核試劑與碳正離子中間體結合,形成加成產物。
反應的決速步由親電試劑進攻而引起的加成反應,故稱為親電加成反應。
親電加成中最常見的不飽和化合物是烯烴和炔烴.
親電加成機理
親電加成有多種機理,包括:碳正離子機理、離子對機理、環鎓離子機理以及三中心過渡態機理.
反應採取哪種機理進行與親電試劑和不飽和化合物的性質、溶劑的極性和過渡態的穩定性等都有很大關係,一般來說,在鹵素加成反應中,溴與烯烴的加成反應主要按照環鎓離子中間體機理進行,而氯與烯烴的加成反應主要按照前兩種機理進行(有時也經過環狀氯正原子)。這主要是因為兩種鹵素原子電負性和原子半徑不同,溴的孤電子對容易和碳正離子p軌道重疊,發生電子云的離域,而氯則不然。
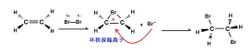 乙烯與溴親電加成
乙烯與溴親電加成不同的機理也會產生立體選擇性不同的產物。碳正離子機理得到順式加成和反式加成產物的混合物,離子對機理得到的是順式加成產物,而環鎓離子機理得到反式加成產物。
對於不對稱的親電加成反應來講,反應一般符合馬氏規則,產物具有區域選擇性。但雙鍵碳上連有吸電子基團或以有機硼化合物作親電試劑時,產物是反馬氏規則的,例如烯烴與乙硼烷生成烷基硼的反應。
主要的親電加成反應類型,對於烯烴,主要有:鹵素加成反應、加鹵化氫反應、水合反應、氫化反應、羥汞化反應、硼氫化-氧化反應、Prins反應,以及與硫酸、次鹵酸、有機酸、醇和酚的加成反應;對於炔烴,主要有:鹵素加成反應、加鹵化氫反應和水合反應。由於sp碳原子的電負性比sp2碳原子電負性強,與電子結合得更為緊密,故炔烴的親電加成反應一般比烯烴要慢。
親電試劑進攻芳香環時,主要發生的不是親電加成反應,而是親電芳香取代反應。其他的加成反應主要機理還有親核加成反應、自由基加成反應和環加成反應。