它的作用
1、降解纖維蛋白和纖維蛋白原
2、水解多種凝血因子(Ⅱ.Ⅴ.Ⅶ.Ⅷ.Ⅹ.Ⅺ)
3、使纖溶酶原轉變為纖溶酶
4、水解補體等
纖溶過程
整個纖溶過程包括兩部分,即纖溶酶原的激活及纖維蛋白或纖維蛋白原的降解。
正文
能專一降解纖維蛋白凝膠的蛋白水解酶,是纖溶系統中的一個重要組份。體內凝血和纖溶兩系統是相互依存緊密相聯的。機體一旦產生凝血反應,也幾乎同時激活了纖溶系統,使體內多餘的血栓移去,並通過負反饋效應使體內纖維蛋白原的水平降低,從而避免纖維蛋白的過多凝聚。整個纖溶過程包括兩部分,即纖溶酶原的激活及纖維蛋白或纖維蛋白原的降解。
激活
纖溶酶原的激活 纖溶酶原有內源性及外源性兩條激活途徑。前者指血液中存在有能使纖溶酶原激活的活化因子,它可能來自靜脈或微靜脈的內皮細胞,其活性在上肢靜脈較之下肢靜脈高,這是下肢靜脈血栓比上肢靜脈多的原因之一。此外在血液中還存在一種活化因子原,當機體的凝血反應一旦被啟動,激活的凝血因子Ⅺ除參與自身的凝血系統外,也同時激活了此活化因子原,後者再進一步激活纖溶酶原。血液中的活化因子原極易被纖維蛋白凝塊所吸附,從而有利於血栓的溶解。
纖溶酶的外源性激活是通過組織活化因子而實現的,此活化因子在子宮、卵巢、腎臟及肺組織中含量尤其豐富。惡性腫瘤初期的變形細胞,胎兒發育期的分化細胞,也能釋放大量活化因子。此外活化因子也存在於尿、唾液、乳汁、膽汁及前列腺等分泌液中,特別是尿中的活化因子,稱之為尿激酶,分子量54000,此酶已高度純化,是纖溶酶原活化因子中研究得最多的。某些細菌也能產生活化因子,如鏈球菌所分泌的鏈激酶。尿激酶與鏈激酶都是有效的抗血栓藥物。
 纖溶酶
纖溶酶纖溶酶原的一級結構已全部闡明,是一條含790個胺基酸殘基的肽鏈,N末端為谷氨酸。尿激酶可按兩條不同途徑激活纖溶酶原(圖1):①尿激酶專一裂解殘基Arg-Val(560~561)間肽鍵,使激活成N末端為谷氨酸的纖溶酶,後者又自身裂解,作用於N端附近的肽鍵Lys-Lys(77~78)或Lys-Val(78~79),並釋放出相應的肽段,最後形成N末端為Lys或Val的纖溶酶,此激活途徑較為緩慢;②體內少量形成的纖溶酶,先使酶原降解,自N端除去77或78個胺基酸殘基的肽段,形成N末端為Lys或Val的纖溶酶原,此時由於構象上的變化,較之完整的纖溶酶原更易被尿激酶所激活,最後也同樣形成N末端為Lys或Val的纖溶酶。
鏈激酶對纖溶酶原的激活則屬於接觸激活。鏈激酶本身並不是一個酶,而是一個分子量為47000 的蛋白質,它與纖溶酶原結合後形成一個等克分子比的複合物,使複合物中纖溶酶原的構象發生變化,並顯示出活化因子的活力,自身催化其餘游離的纖溶酶原,使之轉變為纖溶酶。
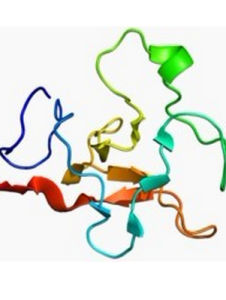
激活後的纖溶酶形成兩條由兩對二硫鍵連結的肽鏈。輕鏈為原肽鏈的C端部分,共含230個胺基酸殘基,其結構類似於胰蛋白酶,酶的活性部位即位於輕鏈。重鏈的N末端為賴氨酸或纈氨酸,C末端即為激活時肽鍵裂解處的精氨酸。此重鏈部分的結構與凝血酶原N端的A及S-肽段非常類似(見凝血因子),系由5個相似環狀結構組成,同樣稱為“環餅”結構(圖2)。5個環狀結構很可能都是同一基因重複表達產生的。環餅結構的特殊性有何功能意義,尚不清楚,有人認為體內纖維蛋白凝膠對纖溶酶的吸附很可能與此結構有關。
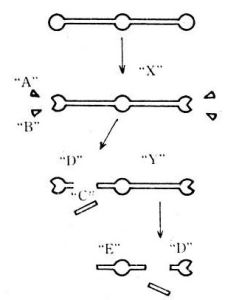
纖維蛋白的降解 纖溶酶在逐步降解纖維蛋白時,釋放出 5個相應的降解碎片A、B、C、D、E。A、B、C為小分子,D、E為大分子。D、E兩片段的分子量分別為80000及48000。片段D以克分子量計算約是片段E的二倍,此外還可得到分子量更大的中間體“X”及“Y”片段。由此推測纖維蛋白的降解過程大致如圖3所示。纖維蛋白降解成“X”片段,並釋放出小分子片段“A”及“B”,後者分別相當於纖維蛋白β肽鏈的N端部分約40~50胺基酸殘基及α 肽鏈C末端的鬆散部分(見凝血因子)。“X”片段再進一步降解為“D”及“Y”片段,D片段相當於纖維蛋白單體的C端主體,而E片段則相當於纖維蛋白單體的中間主體部分,包括二硫鍵節的結構,“C”片段為連線纖維蛋白N
 纖溶酶
纖溶酶參考書目
L.A.Hanson,Plasma Proteins,J.Wiley and Sons, New York,1979.
戚正武:蛋白酶的生物調控作用,《國外醫學》,1982.
降解
纖溶酶在逐步降解纖維蛋白時,釋放出5個相應的降解碎片A、B、C、D、E。A、B、C為小分子,D、E為大分子。D、E兩片段的分子量分別為80000及48000。片段D以克分子量計算約是片段E的二倍,此外還可得到分子量更大的中間體“X”及“Y”片段。由此推測纖維蛋白的降解過程大致如下:纖維蛋白降解成“X”片段,並釋放出小分子片段“A”及“B”,後者分別相當於纖維蛋白β肽鏈的N端部分約40~50胺基酸殘基及α肽鏈C末端的鬆散部分。“X”片段再進一步降解為“D”及“Y”片段,D片段相當於纖維蛋白單體的C端主體,而E片段則相當於纖維蛋白單體的中間主體部分,包括二硫鍵節的結構,“C”片段為連線纖維蛋白N端與C端二主體部位的中間螺鏇區結構。
上述降解產物的片段儘管都不是均一的,但它們在電泳、超離心沉降及免疫特性上彼此都可明顯區分。其中大分子量的降解產物,特別是片段“Y”具有明顯的抗凝作用,即能競爭性抑制凝血酶活力,又能阻止纖維蛋白單體的聚合,從而阻止體內進一步形成纖維蛋白凝膠,這實際上是自身調節的負反饋效應。