簡介
 水熱法
水熱法水熱法是19 世紀中葉地質學家模擬自然界成礦作用而開始研究的。1900 年後科學家們建立了水熱合成理
論,以後又開始轉向功能材料的研究。目前用水熱法已製備出百餘種晶體。水熱法又稱熱液法,屬液相化學法的範疇。是指在密封的壓力容器中,以水為溶劑,在高溫高壓的條件下進行的化學反應。水熱反應依據反應類型的不同可分為水熱氧化、水熱還原、水熱沉澱、水熱合成、水熱水解、水熱結晶等。其中水熱結晶用得最多。在這裡簡單介紹一下它的原理: 水熱結晶主要是溶解———再結晶機理。首先營養料在水熱介質里溶解,以離子、分子團的形式進入溶液。利用強烈對流(釜內上下部分的溫度差而在釜內溶液產生) 將這些離子、分子或離子團被輸運到放有籽晶的生長區(即低溫區) 形成過飽和溶液,繼而結晶。
基本原理
水熱反應過程是指在一定的溫度和壓力下,在水、水溶液或蒸汽等流體中所進行有關化學反應的總稱。按水熱反應的溫度進行分類,可以分為亞臨界反應和超臨界反應,前者反應溫度在100~240℃之間,適於工業或實驗室操作。後者實驗溫度已高達I000℃,壓強高達0.3Gpa,足利用作為反應介質的水在超臨界狀態下的性質和反應物質在高溫高壓水熱條件下的特殊性質進行合成反應。在水熱條件下,水可以作為一種化學組分起作用並參加反應,既是溶劑又是礦化劑同時還可作為壓力傳遞介質;通過參加滲析反應和控制物理化學因素等,實現無機化合物的形成和改性.既可製備單組分微小晶體,又可製備雙組分或多組分的特殊化合物粉末。克服某些高溫製備不可避免的硬團聚等,其具有粉末細(納米級)、純度高、分散性好、均勻、分布窄、無團聚、晶型好、形狀可控和利於環境淨化等特點。
合成裝置
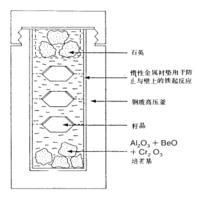
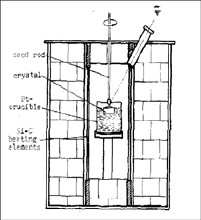
 水熱法
水熱法水熱法合成寶石採用的主要裝置為高壓釜,在高壓釜內懸掛種晶,並充填礦化劑。
高壓釜為可承高溫高壓的鋼製釜體。水熱法採用的高壓釜一般可承受1100℃的溫度和1GPa的壓力,具有可靠的密封系統和防爆裝置。因為具潛在的爆炸危險,故又名“炸彈”(bomb)。高壓釜的直徑與高度比有一定的要求,對內徑為100-120mm的高壓釜來說,內徑與高度比以1:16為宜。高度太小或太大都不便控制溫度的分布。由於內部要裝酸、鹼性的強腐蝕性溶液,當溫度和壓力較高時,在高壓釜內要裝有耐腐蝕的貴金屬內襯,如鉑金或黃金內襯,以防礦化劑與釜體材料發生反應。也可利用在晶體生長過程中釜壁上自然形成的保護層來防止進一步的腐蝕和污染。如合成水晶時,由於溶液中的SiO2與Na2O和釜體中的鐵能反應生成一種在該體系內穩定的化合物,即矽酸鐵鈉(錐輝石NaFeSi2O6)附著於容器內壁,從而起到保護層的作用。礦化劑指的是水熱法生長晶體時採用的溶劑。
礦化劑通常可分為以下五類:
1)鹼金屬及銨的鹵化物,
2)鹼金屬的氫氧化物,
3)弱酸與鹼金屬形成的鹽類,
4)強酸
5)酸類(一般為無機酸)。
其中鹼金屬的鹵化物及氫氧化物是最為有效且廣泛套用的礦化劑。礦化劑的化學性質和濃度影響物質在其中的溶解度與生長速率。合成紅寶石時可採用的礦化劑有NaOH,Na2CO3,NaHCO3+KHCO3,K2CO3等多種。Al2O3在NaOH中溶解度很小,而在Na2CO3中生長較慢,採用NaHCO3+KHCO3混合液則效果較好。
水熱法的特點
1)合成的晶體具有晶面,熱應力較小,內部缺陷少。其包裹體與天然寶石的十分相近。
2)密閉的容器中進行,無法觀察生長過程,不直觀;
3)設備要求高(耐高溫高壓的鋼材,耐腐蝕的內襯)、技術難度大(溫壓控制嚴格)、成本高;
4)安全性能差;
水熱法生產的特點是粒子純度高、分散性好、晶形好且可控制,生產成本低。用水熱法製備的粉體一般無需燒結,這就可以避免在燒結過程中晶粒會長大而且雜質容易混入等缺點。
影響水熱合成的因素
溫度的高低
升溫速度
攪拌速度
反應時間
基於反應原理的製備技術
水熱氧化
採用金屬單質為前驅物.經水熱反應得到相應的金屬氧化物粉體。例如,以金屬鈦粉為前驅物,在一定的水熱條件(溫度高於450℃,壓力100MPa,反應時問3小時)下,得到銳鈦礦型、金紅石型TiO2晶粒和鈦氫化物TiHx(x=1.924)的混合物;反應溫度提高到600℃以上,得到的是金紅石型和TiHx(x=I.924)的混合物;反應溫度高於700℃時,產物則完全是金紅石型TiO2晶粒。採用該法製備的反應時間較短、晶粒尺度均勻、團聚較少。
水熱沉澱
典型的例子之一是採用硫酸鈦配製的溶液和尿素CO(NH2)2混合溶液為反應前驅物,放入高壓釜中,填充度為80%,水熱反應溫度在120一200℃間。經水熱反應在不同的配比下得到銳鈦礦型、金紅石型或者是兩者的混合粉體,晶粒線度為15nm左右。由於在水熱反應過程,尿素首先受熱分解.使溶液PH值增大,鹼性增強,有利於水解反應進行,從而形成水合二氧化鈦,進而生成納米二氧化鈦。
水熱晶化
採用無定形前驅物經水熱反應形成結晶完好的晶粒。如水熱法製備ZrO2晶粒時,以ZrOCl2水溶液中加沉澱劑(氨水、尿素等)得到的Zr(OH)4膠體為前驅物,然後經過水熱反應獲得納米二氧化鋯。
水熱合成
以一元金屬氧化物或鹽在水熱條件下反應合成二元甚至多元化合物。如以SnCl4為原料配製成SnCl4溶液,通過過濾除去不溶物,獲得白色澄清溶液,然後通過使用KOH調整其PH值,水熱反應的溫度在120一220℃之間進行調整,反應1-2小時(升溫速度為3℃/min)。反應完畢後,經過濾洗滌後烘乾即得產‘物。
水熱分解
如天然鈦鐵礦的主要成分是(%) TiO2,53.6l;FeO,20.87;Fe2O3,20.95;MnO,0.98,在10moL的KOH溶液里.溫度為500℃,壓力在25-35MPa下,經63小時水熱處理,天然鈦鐵礦可以完全分解。產物是磁鐵礦Fe(3-x)O3和K2O·TiO2,檢測表明在此條件下.得到的磁鐵礦晶胞參數(a=O.8467nm)大於符合化學計量比的純磁鐵礦的晶胞參數(a=0.8396nm)這是由於Ti4+在晶格里以替位離子形式存在,形成Fe(3-X)O3·Fe2TiO4固溶體。在溫度為800℃、壓力90MPa下,水熱處理24小時則可得到符台化學計量比的純磁鐵礦粉體。
除上述水熱方法外,還有水熱脫水、水熱陽極氧化.機械反應(帶攪拌作用),水熱鹽溶液卸壓法等粉體製備技術。
水熱法套用
製備單晶
製備有機-無機雜化材料
製備沸石
製備納米材料
水熱合成法的優點
(1)明顯降低反應溫度(通常在100~200°C下進行);
(2)能夠以單一反應步驟完成(不需要研磨和焙燒步驟);
(3)很好地控制產物的理想配比及結構形態;
(4)水熱體系合成發光物質對原材料的要求較高溫固相反應低,所用的原材料範圍寬。