氯化冶金
正文
添加氯化劑(Cl2、NaCl、CaCl2等)使欲提取的金屬轉變成氯化物,為製取純金屬作準備的冶金方法。金屬和金屬的氧化物、硫化物或其他化合物在一定條件下大都能與化學活性很強的氯反應,生成金屬氯化物。金屬氯化物與該金屬的其他化合物相比,具有熔點低、揮發性高、較易被還原、常溫下易溶於水及其他溶劑等特點,並且各種金屬氯化物的生成難易和性質上存在著明顯的差異。在冶金中,常常利用上述特性,藉助氯化冶金有效地實現金屬的分離、富集、提取與精煉等目的。早在16世紀中葉就發現含金、銀的礦石在浸取(浸出)過程中,加入一定量的食鹽,可以提高金屬的回收率。18世紀出現了氯化焙燒-浸取法處理貴金屬礦石,效果更好。到19世紀中期,此法擴大套用於處理低品位銅礦石。這是氯化冶金套用的一個重要發展。20世紀20年代,氯化冶金除了套用於鎂的提取之外,還以氯化離析法用於提取有色重金屬(主要是銅)。50年代以來,氯化冶金廣泛用於稀有金屬冶金中。類型 氯化焙燒 視原料性質和下一步處理方法的不同,有中溫氯化焙燒和高溫氯化焙燒:前者是使被提取的金屬氯化物在不揮發的條件下進行,所產生的氯化物可用水或其他溶劑浸取而與脈石分離;後者是在被提取的金屬氯化物能揮發的溫度下進行,所形成的氯化物呈蒸氣狀態揮發,與脈石分離,然後冷凝回收。此法用於菱鎂礦(MgCO3)和金紅石(TiO2)的氯化,以生產鎂和鈦,亦用於處理黃鐵礦燒渣,綜合回收銅、鉛、鋅、金、銀等。
氯化離析 在礦石中加入適量的碳質還原劑(煤或焦炭)和氯化劑,在弱還原性氣氛中加熱,使有價金屬成氯化物揮發,同時氯化物又在炭粒表面被還原為金屬的過程(見離析)。此法已用於處理某些低品位或難選氧化礦(如氧化銅礦)。
氯化熔煉 使要提取的金屬氯化物呈熔融狀態產出的過程。例如通氯氣於氧化鎂和碳質還原劑的混合物中,使鎂變成液態氯化鎂。
氯化精煉 例如,液態粗鋁中所含的雜質,如鈉、鈣和氣體氫,或液態鉛中所含的鋅,都可用氯氣進行精煉。氯化精煉的工業套用較少。
氯化浸取 在水溶液中進行的氯化過程,即濕法氯化,包括鹽酸浸取、氯鹽浸取、氯氣浸取和電氯浸取。
主要內容 可概括為:各種金屬元素或化合物的氯化,氯化物的分離和還原。
金屬氧化物的氯化 反應式為:
 (1)
(1)
 氯化冶金
氯化冶金
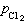 、
、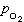 為Cl2和O2的平衡分壓,
為Cl2和O2的平衡分壓,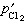 、
、 為Cl2和O2的實際分壓。顯然,要使反應向生成氯化物方向進行,必須保持:
為Cl2和O2的實際分壓。顯然,要使反應向生成氯化物方向進行,必須保持: 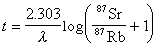
顯然,氣相中氧分壓降低可大大促進氧化物的氯化。常用的還原劑為碳(焦炭、煤和木炭)和一氧化碳。在此情況下,氯化反應按下列各式進行:
MeO+Cl2+C─→MeCl2+CO (2)
2MeO+2Cl2+C─→2MeCl2+CO2 (3)
MeO+Cl2+CO─→MeCl2+CO2 (4)
C或CO與氧化物中的氧結合,可使氯化反應的自由焓變化值減小。例如,1000℃時二氧化鈦的氯化: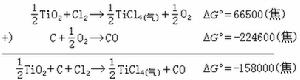
TiCl4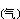 +2Mg
+2Mg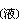 →Ti
→Ti +2MgCl2
+2MgCl2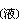 (5)
(5)
特點 氯化冶金具有以下優點:①對原料的適應性強,可處理各種不同類型的原料,甚至液態粗金屬;②作業溫度比其他火法冶金過程低;③分離效率高,綜合利用好。在高品位礦石資源逐漸枯竭的情況下,對儲量很大的低品位、成分複雜難選的貧礦來說,氯化冶金將發揮它的作用。但是尚有三個問題待解決:①提高氯化冶金的經濟效益,其中提高氯化劑的利用效率和氯化劑的再生返回利用是關鍵性問題;②繼續解決氯化冶金設備的防腐蝕;③環境保護。
參考書目
魏壽昆:《冶金過程熱力學》,上海科學技術出版社,上海,1980。