基本概述
 慢病毒慢病毒屬是反轉錄病毒科下的一個屬,包括8種能夠感染人和脊椎動物的病毒,原發感染的細胞以淋巴細胞和巨噬細胞為主,感染個體最終發病。慢病毒感染的顯著特點是感染個體在出現典型的臨床症狀之前,大多經歷長達數年的潛伏期,之後緩慢發病,因此這些病原體被稱為慢病毒。例如人類免疫缺陷病毒(HIV)、猴免疫缺陷病毒(SIV)、馬傳染性貧血(EIA)、貓免疫缺陷病毒(FIV)都是慢病毒屬,慢病毒屬的原文是Lentivirus,其中Lenti-在拉丁文中有慢的意思。
慢病毒慢病毒屬是反轉錄病毒科下的一個屬,包括8種能夠感染人和脊椎動物的病毒,原發感染的細胞以淋巴細胞和巨噬細胞為主,感染個體最終發病。慢病毒感染的顯著特點是感染個體在出現典型的臨床症狀之前,大多經歷長達數年的潛伏期,之後緩慢發病,因此這些病原體被稱為慢病毒。例如人類免疫缺陷病毒(HIV)、猴免疫缺陷病毒(SIV)、馬傳染性貧血(EIA)、貓免疫缺陷病毒(FIV)都是慢病毒屬,慢病毒屬的原文是Lentivirus,其中Lenti-在拉丁文中有慢的意思。慢病毒載體的研究發展得很快,研究的也非常深入。該載體可以將外源基因有效地整合到宿主染色體上,從而達到持久性表達。在感染能力方面可有效地感染神經元細胞、肝細胞、心肌細胞、腫瘤細胞、內皮細胞、幹細胞等多種類型的細胞,從而達到良好的的基因治療效果,在美國已經開展了臨床研究,效果非常理想,因此具有廣闊的套用前景。
套用
慢病毒也被廣泛地套用於表達RNAi的研究中。由於有些類型細胞脂質體轉染效果差,轉移到細胞內的siRNA半衰期短,體外合成siRNA對基因表達的抑制作用通常是短暫的,因而使其套用受到較大的限制。採用事先在體外構建能夠表達siRNA的載體,然後轉移到細胞內轉錄siRNA的策略,不但使脂質體有效轉染的細胞種類增加,而且對基因表達抑制效果也不遜色於體外合成siRNA,在長期穩定表達載體的細胞中,甚至可以發揮長期阻斷基因表達的作用。在所構建的siRNA中,是由RNA聚合酶Ⅲ啟動子來指導RNA合成的,這是因為RNA聚合酶Ⅲ有明確的起始和終止序列,而且合成的RNA不會帶polyA尾。當RNA聚合酶Ⅲ遇到連續4個或5個T時,它指導的轉錄就會停止,在轉錄產物3’端形成1~4個U。U6和H1RNA啟動子是兩種RNA聚合酶Ⅲ依賴的啟動子,其特點是啟動子自身元素均位於轉錄區的上游,適合於表達~21ntRNA和~50ntRNA莖環結構(stemloop)。在siRNA表達載體中,構成siRNA的正義與反義鏈,可由各自的啟動子分別轉錄,然後兩條鏈互補結合形成siRNA;也可由載體直接表達小發卡狀RNA(smallhairpinRNA,shRNA),載體包含位於RNA聚合酶Ⅲ啟動子和4~5T轉錄終止位點之間的莖環結構序列,轉錄後即可摺疊成具有1~4個U3’突出端的莖環結構,在細胞內進一步加工成siRNA。構建載體前通常要通過合成siRNA的方法,尋找高效的siRNA,然後從中挑選符合載體要求的序列,將其引入siRNA表達載體。
載體
慢病毒載體(Lentiviralvector)較逆轉錄病毒載體有更廣的宿主範圍,慢病毒能夠有效感染非周期性和有絲分裂後的細胞。慢病毒載體能夠產生表達shRNA的高滴度的慢病毒,在周期性和非周期性細胞、幹細胞、受精卵以及分化的後代細胞中表達shRNA,實現在多種類型的細胞和轉基因小鼠中特異而穩定的基因表達的功能性沉默,為在原代的人和動物細胞組織中快速而高效地研究基因功能,以及產生特定基因表達降低的動物提供了可能性。慢病毒作為siRNA的攜帶者,不但具備特異性地使基因表達沉默的能力,而且充分發揮了慢病毒載體自身所具備的優勢,為基因功能的研究提供了更強有力的工具。慢病毒載體可以將外源基因或外源的shRNA有效地整合到宿主染色體上,從而達到持久性表達目的序列的效果。對於一些較難轉染的細胞,如原代細胞、幹細胞、不分化的細胞等,使用慢病毒載體,能大大提高目的基因或目的shRNA的轉導效率,且目的基因或目的shRNA整合到宿主細胞基因組的幾率大大增加,能夠比較方便快捷地實現目的基因或目的shRNA的長期、穩定表達。
表達載體
慢病毒表達載體,即通常所說的穿梭載體,包含了包裝、轉染、穩定整合所需要的遺傳信息。慢病毒包裝質粒可提供所有的轉錄並包裝RNA到重組的假病毒載體所需要的所有輔助蛋白。為產生高滴度的病毒顆粒,需要利用表達載體和包裝質粒同時共轉染細胞,在細胞中進行病毒的包裝,包裝好的假病毒顆粒分泌到細胞外的培養基中,離心取得上清液後,可以直接用於宿主細胞的感染,目的基因進入到宿主細胞之後,經過反轉錄,整合到基因組,從而高水平的表達效應分子。
特徵比較
常用的病毒載體有腺病毒、逆轉錄病毒和慢病毒。逆轉錄病毒載體只能感染分裂期細胞,而且容量有限,腺病毒一般不能整合到染色體上,只能進行瞬時感染。與其它逆轉錄病毒相比,慢病毒(LV)具有可以感染非分裂期細胞、容納外源性基因片段大,可以長期表達等顯著優點。慢病毒不產生任何有效的細胞免疫應答,可作為一種體外基因運輸的工具。慢病毒載體介導的轉基因表達能持續數月,且無可觀察到的病理學現象。
慢病毒包裝系統一般由慢病毒表達載體和慢病毒包裝載體組成。
而慢病毒包裝質粒可提供所有的轉錄並包裝RNA到重組的假病毒載體所需要的所有輔助蛋白。為產生高滴度的病毒顆粒,需要利用表達載體和包裝質粒同時共轉染細胞,在細胞中進行病毒的包裝,包裝好的假病毒顆粒分泌到細胞外的培養基中,離心取得上清液後,可以直接用於宿主細胞的感染。
慢病毒包裝系統一般都是三質粒或四質粒包裝系統。其中四質粒系統比三質粒系統在生物安全性上更好一些,所以套用較多。
| 病毒表達系統 | 腺病毒表達系統 | 慢病毒表達系統 | 逆轉錄病毒 |
| 病毒基因組 | 雙鏈DNA病毒 | RNA病毒 | RNA病毒 |
| 是否整合 | 病毒基因組游離於宿主基因組外,瞬時表達外源基因 | 病毒基因組整合於宿主基因組,長時間、穩定表達外源基因 | 病毒基因組整合於宿主基因組,長時間、穩定表達外源基因 |
| 感染細胞類型 | 感染分裂和不分裂細胞 | 感染分裂和不分裂細胞 | 感染分裂細胞,但在幹細胞中表達效率低 |
| 表達豐度 | 高水平表達 | 高水平表達 | 高水平表達 |
| 表達時間 | 快(1-2 天) | 慢(2-4 天) | 快(1-2 天) |
| 滴度 | 滴度高達1012pfu/ml | 最高可達109-10TU/ml | 最高可達109-10TU/ml |
| 克隆容量 | 可插入高達8kb的外源片段,滴度隨插入片段長度增加而降低 | 可插入不超過8kb的外源片段,滴度隨插入片段長度增加而降低 | 可插入不超過6kb的外源片段 |
| 免疫原性 | 高免疫原性 | 低免疫原性 | 低免疫原性 |
| 動物模型 | 不能得到轉基因動物 | 可產生轉基因動物,效率達50以上 | 可以,但很難 |
| 啟動子 | 可以更換特異性啟動子 | 可以更換特異性啟動子 | 不需要啟動子 |
| 能否用於MIRCORNA | 可以 | 可以 | 不可以 |
| 能否用於四環素誘導 | 不可以 | TET-ON,TET-OFF | 不可以 |
目的與意義
●對於一些較難轉染的細胞,如原代細胞、幹細胞、不分化的細胞等,能大大提高目的基因轉導效率,而且目的基因整合到宿主細胞基因組的幾率大大增加,這就為RNAi,cDNA克隆以及報告基因的研究提供了一個有利的途徑。●進行穩轉細胞株的篩選;●為活體動物模型實驗提供高質量的包含目的基因的病毒液;相關實驗
實驗目的對於一些按常規方法難以轉染甚至無法轉染的細胞,通過病毒介導的實驗能夠大大提高基因的轉導效率,以達到目的基因的高效瞬時表達。實驗流程1.根據目的基因相關信息(序列,序列號等),構建含有外源基因或siRNA的重組載體;2.對於測序正確的重組質粒,提取和純化高質量的不含內毒素的重組質粒;3.使用高效重組載體和病毒包裝質粒共轉染293T細胞,進行病毒包裝和生產,收集病毒液;4.濃縮、純化病毒液;5.用高質量的病毒液感染細胞;6.通過定量PCR精確測定病毒滴度(高精確滴定方法)和Western分析實驗結果;7.用高質量的病毒液感染宿主細胞;檢測基因功能或者siRNA的沉默效率以及使用藥物進行穩定轉染細胞株的篩選,通常狀況下,篩選的細胞克隆株具有長期的表達穩定性。病毒液足夠用於一般的動物活體實驗。[1]操作手冊
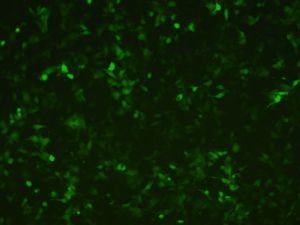
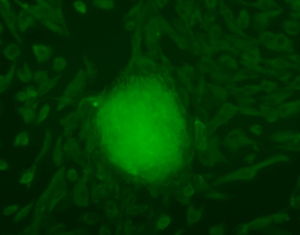 慢病毒1慢病毒使用操作2慢病毒安全使用規範3懸浮細胞感染方法概要4相關專業術語(詳情可參考公司網站FAQ)5細胞培養器皿的相關參數1.慢病毒使用操作手冊1.1慢病毒的儲存與稀釋:1.1.1病毒的儲存:用戶收到病毒液後在很短時間內即使用慢病毒進行實驗,可以將病毒暫時放置於4℃保存;如需長期保存請放置於-80℃(病毒置於凍存管,並使用封口膜封口)A.病毒可以存放於-80℃6個月以上;但如果病毒儲存時間超過6個月,我們建議在使用前需要重新滴定病毒滴度B.反覆凍融會降低病毒滴度:每次凍融會降低病毒滴度10%;因此在病毒使用過程中應僅儘量避免反覆凍融,為避免反覆凍融我們強烈建議客戶收到病毒後按照每次的使用量進行分裝。1.1.2病毒的稀釋:用戶需要稀釋病毒時,請將病毒取出置於冰浴融解後,使用培養目的細胞用PBS或無血清培養基(含血清或含雙抗不影響病毒感染)混勻分裝後4℃保存(請儘量在三天內用完)分裝後使用。1.2慢病毒用於體外(InVitro)實驗:感染培養原代細胞和建系細胞1.2.1慢病毒對各種細胞和組織的親嗜性不同,用戶使用Invabio提供的慢病毒之前可以通過查閱相關文獻,了解慢病毒對您的目的細胞的親嗜性,感染複數(MOI值)以及在體(InVivo)注射所需要的病毒量。如果沒有相關文獻支持,可以通過感染預實驗得到合適的感染複數(MOI值)(使用24孔板檢測病毒對目的細胞的親嗜性)1.2.2慢病毒感染目的細胞預實驗1.2.2.1慢病毒感染目的細胞預實驗注意事項A.測定慢病毒對目的細胞的親嗜性時,需要同時設定對慢病毒親嗜性較高的細胞(HEK293T,Hela)作為平行實驗的對照細胞。B.在進行慢病毒感染實驗時,可以用完全培養基(培養目的細胞用)稀釋;理論上,含有血清,雙抗或者其他營養因子的完全培養基不影響慢病毒的感染效率。C.Invabio提供的病毒單位為TU/ml,即每毫升中含有具有生物活性的病毒顆粒數。如:病毒滴度為>1X108TU/ml即每毫升病毒液中至少含有1X108個具有生物活性的慢病毒顆粒。1.2.2.2以24孔培養板為例,進行目的細胞和HEK293T細胞的感染預實驗實驗前按照不同的MOI設定不同的感染孔,並根據MOI和細胞數量計算所需要的病毒量,如有必要可以使用PBS溶液或者無血清培養基稀釋病毒原液第一天,準備細胞:在24孔培養板接種若干孔,每個孔內接種3~5X104個目的細胞,鋪板時細胞的融合率為50%左右,每孔培養基體積為100μl;進行病毒感染時細胞的融合度約為70%左右。第二天,準備病毒:取出4℃保存的病毒,使用台式離心機離心20秒(使病毒完全懸於離心管底部即可);如果是凍存在-80℃的病毒需要先在冰上融化後使用。亦可以根據實驗室的實際情況將按照MOI準確計算好的慢病毒稀釋到培養基中,並儘可能保證所獲得的含有慢病毒的培養基的總體積為最小體積,以期獲得最佳的感染效率。第二天,感染目的細胞:病毒準備好之後,從培養箱中拿出細胞,首先觀察細胞生長狀態,如細胞狀態較好則開始實驗,a使用移液器吸取準確體積的病毒液加入準備好的培養基b吸去培養基的培養器皿中的培養基(如果細胞生長良好,密度適宜,則不用換液)c在目的細胞和對照細胞中分別加入計算好的病毒液d混勻後放於二氧化碳培養箱(37℃、5%CO2)孵育過夜註:感染前細胞的狀態好壞對最終的感染效果高低影響很大,所以務必保證加病毒之前細胞處於良好的生長狀態亦可以將預先準備好的培養基和慢病毒的混合液直接加入培養器皿中慢病毒對目的細胞的感染效率較低,通過提高MOI值可以提高病毒的感染效率,但是當MOI高於20時,我們建議客戶在培養基中加入ploybrene(8μg/ml左右)來提高病毒的感染效率。A.第三天,更換培養液:一般在24小時候後將含有慢病毒的培養液更換成正常培養液;在感染後觀察細胞狀態,如果慢病毒對細胞有明顯毒性作用而影響細胞生長狀態,可以最短在加病毒4小時候更換新鮮培養液後繼續培養(建議在8-12小時更換為宜)。第一次換液後,如果慢病毒對細胞沒有明顯毒性作用,按照正常培養條件培養換液。B.第六天,感染效率檢測:在倒置螢光顯微鏡觀察螢光,估計慢病毒感染目的細胞的效率;如何由於目的基因較大而造成選擇的載體不能攜帶MarkerGene的,可以通過Real-timeRT-PCR檢測目的基因的表達來拍評估感染效率。注意:Invabio提供的病毒載體上帶有GFP綠色螢光蛋白,用戶可以在病毒感染96小時後用倒置螢光顯微鏡觀察GFP綠色螢光,以觀察病毒對目的細胞的感染情況。如果慢病毒載體攜帶其他MarkerGene如RFP\BFP可以用螢光顯微鏡在對應的激發光波長下觀察螢光表達的情況慢病毒表達時間較慢,螢光表達所需時間較長,建議感染後96小時後觀測螢光表達。感染後的細胞可以連續培養一周,通過觀察螢光的表達時間和表達強度來確定慢病毒對目的細胞的感染情況。感染期間請根據細胞生長的情況對細胞進行及時換液,以保證細胞良好的生長狀態。2.慢病毒使用安全使用規範Invabio提供的慢病毒為“自殺”性病毒,即病毒感染目的細胞後不會再感染其他細胞,也不會利用宿主細胞產生新的病毒顆粒。慢病毒中的毒性基因已經被剔除並被外源性目的基因所取代,屬於假型病毒因此沒有毒性作用。但該病毒仍然具有可能的潛在的生物學危險,Invabio建議不要使用編碼已知或可能會致癌的基因的假型病毒。除非已經完全公認某個基因肯定沒有致癌性,否則均不建議採用假型病毒進行生物學實驗。如有疑問,請與我們聯繫。使用時請參照如下所示進行實驗:2.1.病毒操作時最好使用生物安全櫃。如果使用普通超淨工作檯操作病毒,請不要打開排風機。2.2.病毒操作時請穿實驗服,帶口罩和手套。2.3.操作病毒時特別小心不要產生氣霧或飛濺。如果操作時超淨工作檯有病毒污染,請立即用70%乙醇加1%的SDS溶液擦拭乾淨。接觸過病毒的槍頭,離心管,培養板,培養液請於84消毒液或1%SDS中浸泡過夜後棄去。2.4.用顯微鏡觀察細胞感染情況時應遵從以下步驟:擰緊培養瓶或蓋緊培養板。用70%乙醇清理培養瓶外壁後到顯微鏡處觀察拍照。離開顯微鏡實驗台之前,用70%乙醇清理顯微鏡實驗台。2.5.如需要離心,應使用密封性好的離心管,或者用封口膜封口後離心,而且儘量使用組織培養室內的離心機。2.6.脫掉手套後,用肥皂和水清洗雙手。3.懸浮細胞感染方法概要1.1根據細胞的量將細胞在1.5ml管中離心收集然後用100-200ul的無血清培養液稀釋細胞沉澱,以細胞完全浸沒在培養基中為準1.2按照MOI換算病毒顆粒數量,吸取病毒液加入細胞中,將1.5ml管放在37℃度培養箱中孵育30分鐘1.3將管中混合溶液吸出加到培養皿中或孔里1.4加入足夠量的新鮮培養液1.512小時後換液1.696小時後觀察細胞陽性率4.相關專業術語(詳情可參考公司網站FAQ)常用術語:MOI:病毒感染複數傳統的MOI概念起源於噬菌體感染細菌的研究。其含義是感染時噬菌體與細菌的數量比值,也就是平均每個細菌感染噬菌體的數量。噬菌體的數量單位為pfu。一般認為MOI是一個比值,沒有單位,其實其隱含的單位是pfunumber/cell。後來MOI被普遍用於病毒感染細胞的研究中,含義是感染時病毒與細胞數量的比值,本手冊中提到的MOI都是沿用這個概念。然而,由於病毒的數量單位有不同的表示方式,從而使MOI產生了不同的含義。能產生細胞裂解效應的病毒例如單純皰疹病毒等習慣上仍用pfu表示病毒數量,因此其MOI的含義與傳統的概念相同。MOIstandsfor"MultiplicityofInfection."Itistheratioofinfectiousvirusparticlestothenumberofcellsbeinginfected.TherecommendedMOIisintherangeof0.1(meaningthatyouinoculate1virusparticleforevery10cells)to0.01.ThegeneraltheorybehindMOIistointroduceoneinfectiousvirusparticletoeveryhostcellthatispresentintheculture.However,morethanonevirusmayinfectthesamecellwhichleavesapercentageofcellsuninfected.ThisoccurrencecanbereducedbyusingahigherMOItoensurethateverycellisinfected。5.細胞培養器皿的相關參數
慢病毒1慢病毒使用操作2慢病毒安全使用規範3懸浮細胞感染方法概要4相關專業術語(詳情可參考公司網站FAQ)5細胞培養器皿的相關參數1.慢病毒使用操作手冊1.1慢病毒的儲存與稀釋:1.1.1病毒的儲存:用戶收到病毒液後在很短時間內即使用慢病毒進行實驗,可以將病毒暫時放置於4℃保存;如需長期保存請放置於-80℃(病毒置於凍存管,並使用封口膜封口)A.病毒可以存放於-80℃6個月以上;但如果病毒儲存時間超過6個月,我們建議在使用前需要重新滴定病毒滴度B.反覆凍融會降低病毒滴度:每次凍融會降低病毒滴度10%;因此在病毒使用過程中應僅儘量避免反覆凍融,為避免反覆凍融我們強烈建議客戶收到病毒後按照每次的使用量進行分裝。1.1.2病毒的稀釋:用戶需要稀釋病毒時,請將病毒取出置於冰浴融解後,使用培養目的細胞用PBS或無血清培養基(含血清或含雙抗不影響病毒感染)混勻分裝後4℃保存(請儘量在三天內用完)分裝後使用。1.2慢病毒用於體外(InVitro)實驗:感染培養原代細胞和建系細胞1.2.1慢病毒對各種細胞和組織的親嗜性不同,用戶使用Invabio提供的慢病毒之前可以通過查閱相關文獻,了解慢病毒對您的目的細胞的親嗜性,感染複數(MOI值)以及在體(InVivo)注射所需要的病毒量。如果沒有相關文獻支持,可以通過感染預實驗得到合適的感染複數(MOI值)(使用24孔板檢測病毒對目的細胞的親嗜性)1.2.2慢病毒感染目的細胞預實驗1.2.2.1慢病毒感染目的細胞預實驗注意事項A.測定慢病毒對目的細胞的親嗜性時,需要同時設定對慢病毒親嗜性較高的細胞(HEK293T,Hela)作為平行實驗的對照細胞。B.在進行慢病毒感染實驗時,可以用完全培養基(培養目的細胞用)稀釋;理論上,含有血清,雙抗或者其他營養因子的完全培養基不影響慢病毒的感染效率。C.Invabio提供的病毒單位為TU/ml,即每毫升中含有具有生物活性的病毒顆粒數。如:病毒滴度為>1X108TU/ml即每毫升病毒液中至少含有1X108個具有生物活性的慢病毒顆粒。1.2.2.2以24孔培養板為例,進行目的細胞和HEK293T細胞的感染預實驗實驗前按照不同的MOI設定不同的感染孔,並根據MOI和細胞數量計算所需要的病毒量,如有必要可以使用PBS溶液或者無血清培養基稀釋病毒原液第一天,準備細胞:在24孔培養板接種若干孔,每個孔內接種3~5X104個目的細胞,鋪板時細胞的融合率為50%左右,每孔培養基體積為100μl;進行病毒感染時細胞的融合度約為70%左右。第二天,準備病毒:取出4℃保存的病毒,使用台式離心機離心20秒(使病毒完全懸於離心管底部即可);如果是凍存在-80℃的病毒需要先在冰上融化後使用。亦可以根據實驗室的實際情況將按照MOI準確計算好的慢病毒稀釋到培養基中,並儘可能保證所獲得的含有慢病毒的培養基的總體積為最小體積,以期獲得最佳的感染效率。第二天,感染目的細胞:病毒準備好之後,從培養箱中拿出細胞,首先觀察細胞生長狀態,如細胞狀態較好則開始實驗,a使用移液器吸取準確體積的病毒液加入準備好的培養基b吸去培養基的培養器皿中的培養基(如果細胞生長良好,密度適宜,則不用換液)c在目的細胞和對照細胞中分別加入計算好的病毒液d混勻後放於二氧化碳培養箱(37℃、5%CO2)孵育過夜註:感染前細胞的狀態好壞對最終的感染效果高低影響很大,所以務必保證加病毒之前細胞處於良好的生長狀態亦可以將預先準備好的培養基和慢病毒的混合液直接加入培養器皿中慢病毒對目的細胞的感染效率較低,通過提高MOI值可以提高病毒的感染效率,但是當MOI高於20時,我們建議客戶在培養基中加入ploybrene(8μg/ml左右)來提高病毒的感染效率。A.第三天,更換培養液:一般在24小時候後將含有慢病毒的培養液更換成正常培養液;在感染後觀察細胞狀態,如果慢病毒對細胞有明顯毒性作用而影響細胞生長狀態,可以最短在加病毒4小時候更換新鮮培養液後繼續培養(建議在8-12小時更換為宜)。第一次換液後,如果慢病毒對細胞沒有明顯毒性作用,按照正常培養條件培養換液。B.第六天,感染效率檢測:在倒置螢光顯微鏡觀察螢光,估計慢病毒感染目的細胞的效率;如何由於目的基因較大而造成選擇的載體不能攜帶MarkerGene的,可以通過Real-timeRT-PCR檢測目的基因的表達來拍評估感染效率。注意:Invabio提供的病毒載體上帶有GFP綠色螢光蛋白,用戶可以在病毒感染96小時後用倒置螢光顯微鏡觀察GFP綠色螢光,以觀察病毒對目的細胞的感染情況。如果慢病毒載體攜帶其他MarkerGene如RFP\BFP可以用螢光顯微鏡在對應的激發光波長下觀察螢光表達的情況慢病毒表達時間較慢,螢光表達所需時間較長,建議感染後96小時後觀測螢光表達。感染後的細胞可以連續培養一周,通過觀察螢光的表達時間和表達強度來確定慢病毒對目的細胞的感染情況。感染期間請根據細胞生長的情況對細胞進行及時換液,以保證細胞良好的生長狀態。2.慢病毒使用安全使用規範Invabio提供的慢病毒為“自殺”性病毒,即病毒感染目的細胞後不會再感染其他細胞,也不會利用宿主細胞產生新的病毒顆粒。慢病毒中的毒性基因已經被剔除並被外源性目的基因所取代,屬於假型病毒因此沒有毒性作用。但該病毒仍然具有可能的潛在的生物學危險,Invabio建議不要使用編碼已知或可能會致癌的基因的假型病毒。除非已經完全公認某個基因肯定沒有致癌性,否則均不建議採用假型病毒進行生物學實驗。如有疑問,請與我們聯繫。使用時請參照如下所示進行實驗:2.1.病毒操作時最好使用生物安全櫃。如果使用普通超淨工作檯操作病毒,請不要打開排風機。2.2.病毒操作時請穿實驗服,帶口罩和手套。2.3.操作病毒時特別小心不要產生氣霧或飛濺。如果操作時超淨工作檯有病毒污染,請立即用70%乙醇加1%的SDS溶液擦拭乾淨。接觸過病毒的槍頭,離心管,培養板,培養液請於84消毒液或1%SDS中浸泡過夜後棄去。2.4.用顯微鏡觀察細胞感染情況時應遵從以下步驟:擰緊培養瓶或蓋緊培養板。用70%乙醇清理培養瓶外壁後到顯微鏡處觀察拍照。離開顯微鏡實驗台之前,用70%乙醇清理顯微鏡實驗台。2.5.如需要離心,應使用密封性好的離心管,或者用封口膜封口後離心,而且儘量使用組織培養室內的離心機。2.6.脫掉手套後,用肥皂和水清洗雙手。3.懸浮細胞感染方法概要1.1根據細胞的量將細胞在1.5ml管中離心收集然後用100-200ul的無血清培養液稀釋細胞沉澱,以細胞完全浸沒在培養基中為準1.2按照MOI換算病毒顆粒數量,吸取病毒液加入細胞中,將1.5ml管放在37℃度培養箱中孵育30分鐘1.3將管中混合溶液吸出加到培養皿中或孔里1.4加入足夠量的新鮮培養液1.512小時後換液1.696小時後觀察細胞陽性率4.相關專業術語(詳情可參考公司網站FAQ)常用術語:MOI:病毒感染複數傳統的MOI概念起源於噬菌體感染細菌的研究。其含義是感染時噬菌體與細菌的數量比值,也就是平均每個細菌感染噬菌體的數量。噬菌體的數量單位為pfu。一般認為MOI是一個比值,沒有單位,其實其隱含的單位是pfunumber/cell。後來MOI被普遍用於病毒感染細胞的研究中,含義是感染時病毒與細胞數量的比值,本手冊中提到的MOI都是沿用這個概念。然而,由於病毒的數量單位有不同的表示方式,從而使MOI產生了不同的含義。能產生細胞裂解效應的病毒例如單純皰疹病毒等習慣上仍用pfu表示病毒數量,因此其MOI的含義與傳統的概念相同。MOIstandsfor"MultiplicityofInfection."Itistheratioofinfectiousvirusparticlestothenumberofcellsbeinginfected.TherecommendedMOIisintherangeof0.1(meaningthatyouinoculate1virusparticleforevery10cells)to0.01.ThegeneraltheorybehindMOIistointroduceoneinfectiousvirusparticletoeveryhostcellthatispresentintheculture.However,morethanonevirusmayinfectthesamecellwhichleavesapercentageofcellsuninfected.ThisoccurrencecanbereducedbyusingahigherMOItoensurethateverycellisinfected。5.細胞培養器皿的相關參數 | Flask/Dish | Surface (mm) | Cell number | Media Volume |
| 96 well plate | 50 | 1.5-5.0×10 | 100 ;μl |
| 48 well plate | 100 | 3.0×104-1.0×10 | 200 ;μl |
| 24 well plate | 200 | 8.0×104-2.0×10 | 500 ;μl |
| 12 well plate | 401 | 1.6-4.0×10 | 1.0 ml |
| 6 well plate | 962 | 3.0-8.0×10 | 2.0 ml |
| 35mm | 962 | 3.0-8.0×10 | 2.0 ml |
| 60mm | 2827 | 1.0-2.5×10 | 6.0 ml |
| 100mm | 7854 | 2.5-6.4×10 | 10.0 ml |
 慢病毒
慢病毒 慢病毒
慢病毒
