簡介
絕熱膨脹是指與外界沒有熱量交換,但氣體對外界做功,氣體膨脹。根據熱力學第一定律,可證明這是等熵過程,在這個過程中氣體體積增大,壓強降低,因而溫度降低。
絕熱可逆膨脹或壓縮過程是在系統內外壓力相差無限小的條件下進行的,可用內壓代替外壓求可逆體積功。
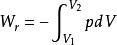 可逆絕熱膨脹過程
可逆絕熱膨脹過程可逆過程的p= f(V)關係稱為可逆過程方程,隨具體途徑而異;對理想氣體可逆恆溫過程p= nRT/V。
理想氣體可逆絕熱過程方程
 可逆絕熱膨脹過程
可逆絕熱膨脹過程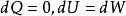 可逆絕熱膨脹過程
可逆絕熱膨脹過程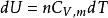 可逆絕熱膨脹過程
可逆絕熱膨脹過程理想氣體:;
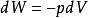 可逆絕熱膨脹過程
可逆絕熱膨脹過程過程可逆:
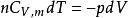 可逆絕熱膨脹過程
可逆絕熱膨脹過程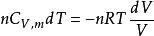 可逆絕熱膨脹過程
可逆絕熱膨脹過程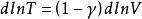 可逆絕熱膨脹過程
可逆絕熱膨脹過程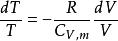 可逆絕熱膨脹過程
可逆絕熱膨脹過程又因為,
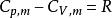 可逆絕熱膨脹過程
可逆絕熱膨脹過程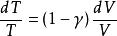 可逆絕熱膨脹過程
可逆絕熱膨脹過程 可逆絕熱膨脹過程
可逆絕熱膨脹過程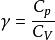 可逆絕熱膨脹過程
可逆絕熱膨脹過程式中,稱作理想氣體的絕熱指數。
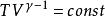 可逆絕熱膨脹過程
可逆絕熱膨脹過程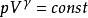 可逆絕熱膨脹過程
可逆絕熱膨脹過程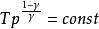 可逆絕熱膨脹過程
可逆絕熱膨脹過程以上三式套用條件:
封閉系統:W'=0,理想氣體、絕熱、可逆過程。
常見錯誤:將上式用於絕熱非可逆過程!
可逆絕熱過程功的計算
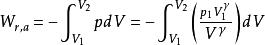 可逆絕熱膨脹過程
可逆絕熱膨脹過程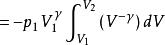 可逆絕熱膨脹過程
可逆絕熱膨脹過程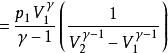 可逆絕熱膨脹過程
可逆絕熱膨脹過程或者
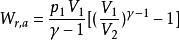 可逆絕熱膨脹過程
可逆絕熱膨脹過程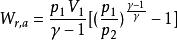 可逆絕熱膨脹過程
可逆絕熱膨脹過程不論可逆與否,絕熱過程的功總可以用 W = △U 來進行計算,這種方法往往較容易。
理想氣體的絕熱可逆線與恆溫可逆線的比較
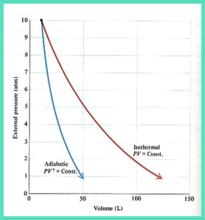 可逆絕熱膨脹過程
可逆絕熱膨脹過程絕熱可逆p - V線斜率:
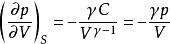 可逆絕熱膨脹過程
可逆絕熱膨脹過程恆溫可逆p - V線斜率:
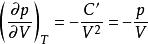 可逆絕熱膨脹過程
可逆絕熱膨脹過程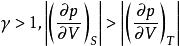 可逆絕熱膨脹過程
可逆絕熱膨脹過程因,即體積膨脹時絕熱線的壓力下降更快,這是因為絕熱時系統不能從環境獲取熱量,消耗內能作功而導致溫度下降。
