介紹
近幾十年來,隨著全球能源需求的持續增長,尋找新能源的研究越來越受到人們的關注。氫能,它作為二次能源,具有清潔、高效、安全、可貯存、可運輸等諸多優點,已普遍被人們認為是一種最理想的新世紀無污染的綠色能源,因此受到了各國的高度重視。
光解水的原理
 光催化光源及實驗系統
光催化光源及實驗系統光催化反應可以分為兩類“降低能壘”(down hil1)和“升高能壘”(up hil1)反應。光催化氧化降解有機物屬於降低能壘反應,此類反應的△G<0,反應過程不可逆,這類反應中在光催化劑的作用下引發生成O2-、HO2 、OH·、和H+ 等活性基團。水分解生成H2和O2則是高能壘反應,該類反應的△G>0(△G=237 kJ/mo1),此類反應將光能轉化為化學能。
要使水分解釋放出氫氣,熱力學要求作為光催化材料的半導體材料的導帶電位比氫電極電位EH+/H2稍負,而價帶電位則應比氧電極電位Eo2/H2O稍正。光解水的原理為:光輻射在半導體上,當輻射的能量大於或相當於半導體的禁頻寬度時,半導體內電子受激發從價帶躍遷到導帶,而空穴則留在價帶,使電子和空穴發生分離,然後分別在半導體的不同位置將水還原成氫氣或者將水氧化成氧氣。Khan等提出了作為光催化分解水制氫材料需要滿足:高穩定性,不產生光腐蝕;價格便宜;能夠滿足分解水的熱力學要求;能夠吸收太陽光。
光催化劑研究
鉭酸鹽
鉭酸鹽ATaO3(A =Li,K) ,A2SrTa2O7 · nH2O (A = H, K, Rb) 等雖然化學成分不同,但是它們的晶體結構類似,共同點是都具八面體TaO6。Kato H等對鉭酸鹽系列的LiTaO3 、NaTaO3、KTaO3的光催化活性進行了研究,發現無負載的LiTaO3、NaTaO3在紫外光的照射下均取得了較好的光催化效果,而負載NiO的NaTaO3,在紫外光的照射下,其分解水的活性顯著提高,量子效率達到了28%,然而當LiTaO3和KTaO3負載NiO後,其光催化活性反而降低了,其原因可從鉭酸鹽的導帶位置得到解釋,NaTaO3的導帶位置比NiO的導帶高,因此,在NaTaO3的導帶產生的光生電子很容轉移到NiO的導帶上,從而增強了電子和空穴的分離,提高了光催化活性。KTaO3的導帶位置比NiO的導帶位置低,不能產生這種效果;而LiTaO3在負載NiO以後,Li+摻雜到NiO當中,造成NiO催化劑的失活,使LiTaO3的光催化活性降低了。Kudo A發現鹼金屬、
鹼土金屬鉭酸鹽作為一種在紫外光線下分解水的催化材料,在沒有負載物的條件下表現出很高的活性,在該類催化劑中摻雜La後,NiO / NaTaO3表現出最高的活性。Ikeda S等用水熱法合成了Ca2Ta2O7、Na2Ta2O6、K2Ta2O6,將負載NiO的Ca2Ta2O7和純Ca2Ta2O7分別放在0.1 mmol dm3的NaOH溶液中,通過紫外光的照射,發現到反應結束時,NiO/Ca2Ta2O7比純Ca2Ta2O7節省了6小時,反應前後分別用XRD進行分析,表明Ca2Ta2O7沒有發生晶型結構變化。將NiO/Na2Ta2O6、 NiO/ K2Ta2O6 、NiO/ Ca2Ta2O7三者進行對比實驗,發現NiO/ Na2Ta2O6 和NiO/K2Ta2O6比NiO/ Ca2Ta2O7的催化能力強,這可能是由於Ca2Ta2O7的能隙比Na2Ta2O6、K2Ta2O6的窄,也可能是由於Ca2Ta2O7的晶體化程度沒有Na2Ta2O6、K2Ta2O6高。Yoshioka K等研究了SrTa2O6、Sr4Ta2O9、Sr5Ta4O15 、Sr2Ta2O7 對水的催化活性,發現它們的催化活性依次為Sr2Ta2O7 > Sr5Ta4O15 > SrTa2O6 > Sr4Ta2O9,這主要是由於它們的晶型結構的不同。
鈮酸鹽
方亮等在BaO—La2O3一TiO2一Nb2O5 體系中合成的具有5層類鈣鈦礦結構的新鈮酸Ba5LaTi2Nb3O18,X射線單晶衍射結果表明,Ba5LaTi2Nb3O18晶體為三方晶系,晶胞參數a=0.57325(2)nm,c=4.2139(2)nm,Z=3,理論密度6.181g/cm3。[(Nb,Ti)O6]八面體共用角頂聯結,在C軸方向上由5個八面體高構成平行於(001)面的類鈣鈦礦層,2個類鈣鈦礦層之間通過Ba原子聯結形成三維結構。K4Nb6O17由NbO6八面體單元通過氧原子形成二維層狀結構的能隙由O的2p軌道決定的價帶能級和Nb的3d軌道決定的導帶能級所決定,在光催化過程中催化劑受到能量大於其能隙的光子輻射後,價帶電子發生躍遷,在半導體粒子中產生電子-空穴對,從而發生氧化還原反應。K4Nb6O17結構上最特別的是交替地出現兩種不同的層空間一層間I和層間II。層間I中K+能被Li+ 、Na+和一些多價陽離子所替代,而在層間II中的K僅能被Li 、Na 等一價陽離子交換。另外一個特徵是,K4Nb6O17的層間空間能自發地發生水合作用。這種材料在高濕度的空氣和水溶液中容易發生水合。這表明,反應物分子水在光催化反應中容易進入層狀空間。Unal U等用ESD(Electrostatic self-assembly deposition)的方法將Ru(bpy)32+置入層狀K4Nb6O17的夾層中,使其吸收帶發生紅移,在可見光的照射下可以產生光電流。在水和甲醇混合溶液中,通過可見光照射,可以產生H2。
鈦酸鹽
在鈦酸鹽這類化合物中,TiO8八面體共角或共邊形成帶負電的層狀結構,帶正電的金屬離子填充在層與層之間,而扭曲的TiO8八面體被認為在光催化活性的產生中起著重要作用。YuWei T等將Au負載到K2La2Ti3O10上用於光解水反應,研究發現負載Au的K2La2Ti3O10光催化活性顯著增強,而且發現產氫率在紫外區域較底,在可見光區域較高。Yanagisawa等把K2CO3、TiO2、CuO按1:2.5(1-x):2.5的比例,在1200oC下反應5h,然後在1mol/L 的 HCl中進行離子交換,製成Cu2+摻雜的H2Ti4O9。隨著Cu2+ 含量的增加,Cu2+摻雜的H2Ti4O9逐漸由單斜晶系變為斜方晶系。實驗證明,單斜晶系的催化活性高於斜方晶系。在波長大於400nm的可見光輻射下,當Cu2+含量為0.43wt%時,從Na2S溶液中分解產生H2的速率最大。如果催化劑的層間有Pt柱時,其光催化活性可以大大增強,甚至可以將純水分解成化學計量比的H2和O2。這是因為在半導體柱和母層之間的電子轉移發生得很快,可以有效地實現電子空穴對的分離,從而增強光催化活性。Machida M等通過分步交換的方法用過渡金屬部分取代三鈦酸鹽和四鈦酸鹽中的一部分鈦製得多孔柱狀光催化材料Na2Ti3-x MxO7和K2Ti4-xMxO9(M =Mn、Fe、Co、Ni、Cu,x≤0.3),用於光催化分解水。Jinshu W等合成同時摻雜La和N 的SrTiO3,並用波長在290—400nm的光照射,發現摻雜La和N的SrTiO3光催化活性是純SrTiO3的2.6倍。
多元硫化物
ZnSeS類化合物能夠形成固溶體,且能隙較窄,許雲波等採用化學共沉澱法製備了摻雜Cu、In的ZnSeS光催化劑,研究發現:在ZnSeS中摻雜Cu、In的摩爾分數為2%時其光吸收性能最好,最大吸收邊紅移至700nm;紫外光照射下該催化劑光分解水產氫的量子效率達到4.83%;催化劑具有良好的熱穩定性和光學穩定性,反應100h其產氫性能沒有衰減。具有立方晶型的Znln2S4,其頻寬為2.3eV,具有可見光回響特徵,且穩定性良,可用作光催化材料。Lei Z..等通過水熱合成法製備了高比表面積的立方尖晶石結構的Znln2S4,負載2%Pt後在0.43mol/LNa2S-0.5mol/L Na2SO3溶液中的產氫率最大可達213µmol/h。Kudo A.等研究發現AgInZn7S9在無Pt助催化劑的情況下,可受可見光激發從含有SO32-或S2-的水溶液中制氫;負載Pt後催化活性更佳,最大產氫率可達970µmol/h。楊運嘉製備了Zn0.957Cu0.043S 和Zn0.999Ni0.001S,其中
Zn0.957Cu0.043S在可見光照射下,自K2SO3和Na2S
水溶液中釋放出H2,Zn0.999Ni0.001S在N2流下、於770K熱處理也可自K2SO3和Na2S水溶液中釋放出H2。文麗榮等製備C60水溶液後,將其與Zn0.999Ni0.001S混合,並採用氣相色譜法跟蹤反應,發現氫氣釋放量是未加C60時的4倍多。由於C60為強電負性物質,與Zn0.999Ni0.001S混合後,可作為電子的淺勢捕獲阱,有效地抑制了電子和空穴的複合,從而促進了反應的發生。
提高性能途徑
光催化劑納米化
納米微粒由於尺寸小,表面所占的體積百分數大,表面的鍵態和電子態與顆粒內部不同,表面原子配位不全等導致表面的活性位置增加,這就使它具備了作為催化劑的基本條件。納米半導體比常規半導體光催化活性高得多,原因在於:由於量子尺寸效應使其導帶和價帶能級變成分立能級,能隙變寬,導帶電位變得更負,而價帶電位變得更正,這意味著納米半導體粒子具有更強的氧化或還原能力。納米TiO2粒子不僅具有很高的光催化活性,而且具有耐酸鹼腐蝕和光化學腐蝕、成本低、無毒,這就使它成為當前最有套用潛力的一種光催化劑。
離子摻雜
離子的摻雜產生離子缺陷,可以成為載流子的捕獲阱,延長其壽命。離子尺寸的不同將使晶體結構發生一定的畸變,晶體不對性增加,提高了光生電子-空穴分離效果。趙秀峰等製備了摻雜鉛的TiO2薄膜。研究發現,鉛的摻雜使薄膜的吸收帶邊發生不同程度的紅移。Yanqin W等用水熱法和溶膠-凝膠法合成了La3+離子摻雜的TiO2納米粒子,並對其進行光電化學行為研究,發現摻雜0.5%mol La3+離子的TiO2電極,其光電轉換效率大大高於純TiO2電極的光電轉換效率。
相對於金屬離子摻雜,非金屬離子摻雜光催化劑的研究較少。Asahi等日本學者報導的氮摻雜TiO2,才真正引起了人們對非金屬離子摻雜光催化劑的廣泛興趣。Shahed等 通過控制CH4和O2流量,以近850℃的火焰灼燒0.25mm鈦片,獲得了真正意義上的C4-摻雜TiO2膜CM-TiO2。XRD譜圖顯示摻雜膜中TiO2主要以金紅石形式存在,譜圖中沒有出現Ti-C的衍射峰;XPS結果表明所製備的改性膜的TiO2組成可表達為TiO1.85 C0.15 。在光吸收性能方面由UV-Vis實驗證實CM-TiO2對可見光有明顯的吸收,並具有兩個吸收帶邊,分別位於440和535nm,對應2.82eV和2.32eV的禁頻寬度。CM-TiO2,可在150W氙燈照射下光解水,並按照2:1的摩爾比生成H2和O2。
半導體複合
近幾年來,對半導體複合進行了許多研究,複合半導體使吸收波長大大紅移,催化活性提高,這可歸因於不同能級半導體間光生載流子易於分離。此外,複合半導體的晶型結構也使光催化活性得到提高。柳清菊等 採用溶膠-凝膠法及浸漬提拉法在普通的載玻片上製得了TiO2/Fe2O3複合薄膜,分析結果表明:複合薄膜均優於純TiO2薄膜的光催化活性,Fe2O3的摩爾含量為0.5%時光催化活性最好。李昱昊等採用浸漬法製備了CdS/TiO2複合半導體光催化劑,對樣品的表面組成及光吸收特性進行了分析,結果表明,樣品中的硫主要以CdS形式存在,其外層包裹了一層CdSO4;由於在TiO2表面修飾了CdS,使樣品的吸收帶邊由400nm(3.1eV)紅移至530nm(2.3eV)。梅長松等用溶膠-凝膠和浸漬-還原相結合方法製得M/WO3-TiO2(M=Pd,Cu,Ni,Ag)光催化劑,分析結果表明,金屬負載在複合半導體上延遲了TiO2由銳鈦礦向金紅石相轉化,增強W與載體TiO2的相互作用,使TiO2對可見光部分的吸收明顯增加;固體材料吸光性能強弱順序Pd/WO3-TiO2>Cu/WO3-TiO2>Ag/WO3-TiO2>Ni/WO3 -TiO2。
染料光敏化
光活性化合物吸附於光催化劑表面,利用這些光活性物質在可見光下有較大的激發因子的特性,只要活性物質激發態電勢比半導體導帶電勢更負,就可能將光生電子輸送到半導體材料的導帶,從而擴大激發波長範圍,增加光催化反應的效率。常用的光敏化劑包括菁染料、酞菁、 香豆素、葉綠素、曙紅、聯吡啶釕等。Stergiopoulos T.等考察了商用有機釕N3和兩種新型染料Ru (dcmpp) (debpy)CI(PF6)(簡寫為Ru-CI)和Ru(dcmpp) (debpy) NCS(PF6)(簡寫為Ru-NCS)的光譜性質和在二氧化鈦表面的化學吸附性能,分別以這3種有機釕作敏化劑,組裝了3種納米晶TiO2太陽能電池,研究了相應太陽能電池的光電性能。結果表明,這3種敏化劑對可見光均有良好的吸收,吸收波長拓展到700nm 以上,在整個太陽光波長範圍內,N3敏化電極對光的吸收強度最大。
貴金屬沉積
常用的沉積貴金屬主要是第Ⅷ族的Pt、Ag、Ir、Au、Ru、Pd、Rh等。在催化劑的表面沉積適量的貴金屬有利於光生電子和空穴的有效分離以及降低還原反應(質子的還原、溶解氧的還原)的超電壓,從而大大提高催化劑的活性。實際上,當半導體表面和金屬接觸時,載流子重新分布,電子從費米能級較高的n-半導體轉移到費米能級較低的金屬,直到它們的費米能級相同,從而形成肖特基勢壘( schottky barrier) ,正因為肖特基勢壘成為俘獲激發電子的有效陷阱,光生載流子被分離,從而抑制了電子和空穴的複合。半導體的表面覆蓋率往往是很小的,例如負載10%的Pt(wt),只有6%的半導體表面被覆蓋。金屬TiO2,表面的沉積量必須控制在合適的範圍內,沉積量過大有可能使金屬成為電子和空穴快速複合的中心,從而不利於光催化反應。井立強等在ZnO納米粒子的表面沉積適量的貴金屬Pd或Ag後,其光催化活性大幅度提高。對於貴金屬Pd來說,最佳沉積量為0.5%,對於貴金屬Ag來說,最佳沉積量為0.75%。
電子捕獲劑
光激發產生的電子和空穴主要經歷捕獲和複合兩個相互競爭的過程。因此選用適當的電子捕獲劑捕獲電子,使複合過程受到抑制,是提高光催化活性的一個重要途徑。將適當的電子捕獲劑預先吸附在催化劑的表面,界面電子傳遞和被捕獲過程就會更有效,更有競爭力。一般可以加人O2、H2O2和過硫酸鹽等電子捕獲劑,可以捕獲光生電子,降低光生電子和空穴的複合,提高光催化率。
表面螯合及衍生作用
常用螯合劑包括:含硫化合物、OH-、EDTA、等。光催化劑表面的部分金屬離子與某種螯合劑發生螯合作用或生成衍生物,改善界面電子轉移效果,同時螯合劑通過表面共價結合形成光催化體系,改變了光催化劑的能帶位置,增強對可見光區域光的吸收,提高光催化劑的催化活性。
外場耦合
外場耦合是利用外場與光場的耦合效應來提高光催化反應的性能。外場包括熱場、電場、微波場、超音波場等。熱場是通過提高反應體系溫度的來提高反應的速率,增加催化劑的光吸收。電場是在光電催化反應體系中,半導體/電解質界面空間電荷層的存在有利於光生載流子的分離,而光生電子和空穴注入溶液的速度不同,電荷分離的效果也不同,為了及時驅走半導體顆粒表面的光生電子,可以通過向工作電極施加陽極偏壓來實現,從而提高界面的氧化效率。微波場可以增加催化劑的光吸收,抑制載流子的複合,促進表面羥基生成羥基自由基。超音波利用聲波的造穴作用,也就是溶液中氣泡的形成、成長和內爆氣泡的爆裂導致體系局部的高能狀態:高溫、高壓以及放電效應和等離子效應。
光解水系統
光解水系統也稱光解水制氫系統或光解水產氫系統,是利用真空系統,在常壓下進行光照實驗,產生的氫氣利用氣體攪拌器在系統中攪拌均勻,可以線上取樣進入氣相色譜進行檢測,保證了樣品取出到檢測過程的真空性和一致性,減少測試數據的誤差,保證微量氫氣線上監測的準確性。
 perfectlight光解水系統
perfectlight光解水系統與傳統光催化水制氫實驗方式相比,光解水制氫系統具備以下技術特點:
占地面積小:系統總大小僅為680*450*980mm,放在實驗台上或實驗室地上都可以,為國內實驗室節省了很多寶貴的實驗空間。
線上檢測: 穩定的氣體線上收集檢測系統,真空環境定量取樣,使檢測數據更加準確。
真空進樣:進樣系統與真空反應系統無縫連線,不但保證了進樣時的氣密性,還可以手
動進樣製作氫氣標樣的標準曲線。
操作便捷:一站式服務,即裝即用,進樣、取樣、檢測僅需搬動一個真空閥門,操作非
常簡單,最大程度簡化實驗過程。
系統兼容性強:本系統不但可以進行光催化水制氫實驗,還可以兼容光催化電解水制氫、
熱催化水制氫及常壓下二氧化碳制甲醇等適合真空系統線上檢測的催化實驗。
高氣密性閥體:perfectlight的光解水系統,可改用玻璃閥體,大大增加了系統氣密性問題,對於制氫的輔助實驗“制氧”完全可以完成實驗過程。
最新訊息
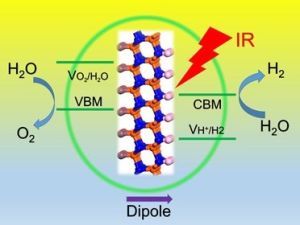
ICQD中心成員楊金龍教授研究組最近提出了一種新的光解水的催化機制,使得利用紅外光進行光解水制氫成為可能,為今後全頻譜利用太陽能鋪平了道路。楊金龍教授研究組提出具有內稟電偶極矩的二維納米催化劑,可突破傳統理論對催化劑能隙(1.23eV)的限制。此成果於2014年1月8日發表在物理評論快報上。[Phys. Rev. Lett. 112, 018301 (2014)]。
中國科學技術大學熊宇傑教授課題組設計出一類具有原子精度殼層結構的助催化劑,在降低貴金屬鉑助催化劑用量的同時,大幅度提高光解水制氫性能,為開發低成本、高性能光催化材料提供了新的途徑。該成果於2015年10月15日線上發表在國際重要化學期刊《德國套用化學》上,並被選為該期刊的“非常重要論文”。
結語
迄今為止,人們所研究和發現的光催化劑和光催化體系仍然存在諸多問題,如光催化劑大多僅在紫外光區穩定有效,能夠在可見光區使用的光催化劑不但催化活性低,而且幾乎都存在光腐蝕現象,需使用犧牲劑進行抑制,能量轉化效率低,這些阻礙了光解水的實際套用。光解水的研究是一項艱巨的工作,雖然近期取得了一些進展,但是還有很多工作需要進一步研究,如研製具有特殊結構的新型光催化劑、新型的光催化反應體系,對提高光催化性劑性能的方法進行更加深的研究等,這些都是今後光解水的研究重點。