人物經歷
 生活中的顏寧教授
生活中的顏寧教授1996年-2000年清華大學生物科學與技術系學士;
2000年-2004年美國普林斯頓大學分子生物學系,博士;
2005年-2007年 美國普林斯頓大學分子生物學系,博士後;
2007年-至今清華大學教授、博士生導師;
2017年5月7日從清華大學證實,顏寧已接受美國普林斯頓大學邀請,受聘該校分子生物學系雪莉·蒂爾曼終身講席教授的職位。
榮譽獲獎
2011年8月獲國家傑出青年科學基金資助
 顏寧·老師
顏寧·老師2012年 獲霍華德·休斯醫學研究所國際青年科學家獎
2012年12月獲中國青年女科學家獎
2014年12月入選選教育部“長江學者獎勵計畫”特聘教授
2015年2月獲國際蛋白質學會“青年科學家獎”,表彰其在跨膜物質運輸的結構生物學領域所做出的一系列傑出工作
2015年10月獲賽克勒國際生物物理獎,表彰其對包括具有里程碑意義的人源葡萄糖轉運蛋白GLUT1在內的關鍵膜蛋白的結構生物學研究做出突出貢獻
2016年6月因觀察到了蛋白質在原子層面如何工作,並對細胞膜上嵌入蛋白質的結構展開了深入研究,入選《自然》雜誌評選的“中國科學之星“”(Science stars of China)
2016年12月基於“肌肉興奮-收縮偶聯的分子機理探索”項目入選2016年度“中國高等學校十大科技進展”
2017年3月15日,華人盛典組委會公布顏寧獲得 2016-2017 年度 “影響世界華人大獎” 提名
2017年12月15日,榮獲“影響中國”2017年度科技人物 。
科學研究
研究領域
人類基因組中編碼蛋白的所有基因約有30%編碼膜蛋白(membrane proteins)。膜蛋白在一切生命過程中起著關鍵作用,具有重要的生理功能。FDA批准上市的藥物中,約50%的作用靶點為膜蛋白。因此,對膜蛋白結構與功能的研究具有極高的生物學意義及醫藥套用前景。
 顏寧
顏寧轉運蛋白(transport proteins)是膜蛋白的一大類,介導生物膜內外的化學物質以及信號交換。脂質雙分子層在細胞或細胞器周圍形成了一道疏水屏障, 將其與周圍環境隔絕起來。儘管有一些小分子可以直接滲透通過膜,但是大部分的親水性化合物,如糖,胺基酸,離子,藥物等等,都需要特異的轉運蛋白的幫助來通過疏水屏障。因此,轉運蛋白在營養物質攝取,代謝產物釋放以及信號轉導等廣泛的細胞活動中起著重要的作用。大量疾病都與膜轉運蛋白功能失常有關,轉運蛋白是諸如抗抑鬱劑,抗酸劑等大量藥物的直接靶點。
研究主要集中在次級主動運輸蛋白(secondary active transporters)的工作機理上。交替通路模型(alternating-access model)被用來解釋轉運蛋白的工作機理,在這個模型中,轉運蛋白至少採取兩種構象來進行底物的裝載及卸載:一種向膜外開放,一種向膜內開放。有許多結構和生物物理學證據支持這個模型。但是,仍有兩個最有趣的基本問題沒有解決。第一,主動運輸的能量偶在線上制是什麼?第二,在轉運過程中,是什麼因素觸發了轉運蛋白的構象變化?使用基於結構的研究手段對次級主動運輸蛋白進行研究,以期解決轉運蛋白工作機理中的基本問題。
研究成果
 顏寧
顏寧2014年,顏寧率領的團隊在世界上首次解析了人源葡萄糖轉運蛋白GLUT1的三維晶體結構,2015年進一步獲得了具備更多構象的GLUT3結合底物和抑制劑的超高解析度結構,從而清晰揭示了葡萄糖跨膜轉運這一基本細胞過程的分子基礎。此外,她還對離子通道結構生物學領域做出重要貢獻,解析了電壓門控鈉離子通道的晶體結構,最近又利用最新冷凍電鏡技術獲得了最大鈣離子通道RyR1的高解析度結構。
2015年進一步獲得了具備更多構象的GLUT3結合底物和抑制劑的超高解析度結構,從而清晰揭示了葡萄糖跨膜轉運這一基本細胞過程的分子基礎 。
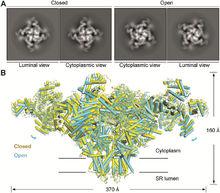 2016年9月-Science-關閉及開放構象的RyR2
2016年9月-Science-關閉及開放構象的RyR22016年9月,顏寧教授研究組與加拿大卡爾加里大學陳穗榮研究組合作在《Science》(DOI:10.1126/science.aah5324)發表研究長文,揭示了目前已知分子量最大的離子通道Ryanodine受體RyR2亞型處於關閉和開放兩種狀態的三維電鏡結構,探討了RyR2的門控機制。通過比較關閉和開放狀態的兩個結構,發現位於穿膜區域負責通透離子的通道有明顯的變化:在開放構象中,該通道發生擴張,從而使得鈣離子能夠順利地從肌質網內部轉移到細胞質中。通過對RyR2中每個相對獨立的結構域的仔細比較和分析,認為中心結構域極有可能是引發RyR開放的關鍵,這一發現與之前有關RyR的功能研究結論相吻合。另外,研究組還獲得了解析度為5.7埃的RyR1開放構象結構,並基於結構比對,初步分析了RyR1的門控機理,有關RyR1的成果已分別發表在《Nature》(Doi:10.1038/nature14063)和《 Cell Research》(Doi:10.1038/cr.2016.89)上,有關Ca1.1的論文已分別發表於《 Science》(DOI: 10.1126/science.aad2395)和《Nature》(Doi:10.1038/nature19321)雜誌上。上述研究與最新的這篇研究論文極大地促進了人們對於興奮-收縮偶聯的理解。
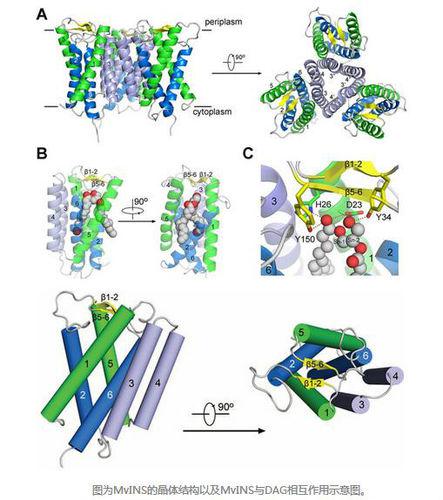 解析·蛋白結構與功能
解析·蛋白結構與功能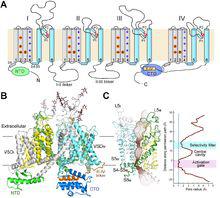 2017年2月,真核生物電壓門控鈉離子通道的拓撲圖和三維電鏡結構
2017年2月,真核生物電壓門控鈉離子通道的拓撲圖和三維電鏡結構2017年2月,顏寧教授研究組在《科學》(Science, DOI: 10.1126/science.aal4326)線上發表了題為“Structure of a eukaryotic voltage-gated sodium channel at near atomic resolution”的研究長文,在世界上首次報導了真核生物電壓門控鈉離子通道(以下簡稱“鈉通道”)的3.8 Å解析度的冷凍電鏡結構,為理解其作用機制和相關疾病致病機理奠定了基礎;研究組成功地獲得了性質良好的蛋白樣品,並利用單顆粒冷凍電鏡的方法,重構出了可以清晰分辨絕大多數側鏈的真核生物鈉離子通道(命名為NavPaS)的三維結構,他們利用電鏡技術,但反其道而行之,放棄了對於大分子量蛋白的追求,而利用序列分析選取長度最短的真核鈉離子通道,成功利用重組技術獲得了表達量較高、性質穩定均一的美洲蟑螂的鈉通道蛋白。該結構的解析為理解鈉通道的離子選擇性、電壓依賴的激活與失活特性、配體抑制機理提供了重要的分子基礎,為解釋過去60多年的大量實驗數據提供了結構模板,並為基於結構的分子配體開發奠定了基礎。
代表論文
Sun L, Zeng X, Yan C, Sun X, Gong X, Rao Y, Yan N. Crystal structure of a bacterial homologue of glucose transporters GLUT1–4. Nature, 2012; 490:361–366.
Yin P, Deng D, Yan C, Pan X, Xi JJ, Yan N*, Shi Y*.Specific DNA-RNA Hybrid Recognition by TAL Effectors. Cell Rep. 2012; Sep 26. Epub ahead of print (co-corresponding authors)
Deng D, Yin P, Yan C, Pan X, Gong X, Qi S, Xie T, Mahfouz M, Zhu JK, Yan N*, Shi Y*. Recognition of methylated DNA by TAL effectors. Cell Res. 2012;22(10):1502-4. (co-corresponding authors)
Zhang X, Ren W, DeCaen P, Yan C, Tao X, Tang L, Wang J, Hasegawa K, Kumasaka T, He J, Wang J, Clapham DE, Yan N. Crystal structure of an orthologue of the NaChBac voltage-gated sodium channel. Nature. 2012;486(7401):130-4.
Tian Xie, Ruobing Ren, Yuan-yuan Zhang, Yuxuan Pang, Chuangye Yan, Xinqi Gong, Yuan He, Wenqi Li, Di Miao, Qi Hao, Haiteng Deng, Zhixin Wang, Jia-Wei Wu and Nieng Yan. Molecular Mechanism for Inhibition of a Critical Component in the Arabidopsis thaliana Abscisic Acid Signal Transduction Pathways, SnRK2.6, by Protein Phosphatase ABI1. J Biol Chem. 2012; 287:794-802.
Dong Deng, Chuangye Yan, Xiaojing Pan, Magdy Mahfouz, Jiawei Wang, Jian-Kang Zhu, Yigong Shi*, and Nieng Yan* Structural basis for the specific recognition of DNA by TAL effectors. Science. 2012; 335(6069):720-3, Epub: 2012 Jan 5. (* indicates corresponding authors).
Hao Q, Yin P, Li W, Wang L, Yan C, Lin Z, Wu JZ, Wang J, Yan SF, Yan N. The molecular basis of ABA-independent inhibition of PP2Cs by a subclass of PYL proteins.Mol Cell. 2011;42(5):662-72.
Lu F, Li S, Jiang Y, Jiang J, Fan H, Lu G, Deng D, Dang S, Zhang X, Wang J, Yan N. Structure and mechanism of the uracil transporter UraA. Nature. 2011;472(7342):243-6.
Dang S, Sun L, Huang Y, Lu F, Liu Y, Gong H, Wang J, Yan N. Structure of a fucose transporter in an outward-open conformation. Nature. 2010;467(7316):734-8.
Yuan X, Yin P, Hao Q, Yan C, Wang J, Yan N. Single amino acid alteration between valine and isoleucine determines the distinct pyrabactin selectivity by PYL1 and PYL2. J Biol Chem. 2010; 285(37):28953-8.
Hao Q, Yin P, Yan C, Yuan X, Li W, Zhang Z, Liu L, Wang J, Yan N. Functional mechanism of the abscisic acid agonist pyrabactin. J Biol Chem. 2010;285(37):28946-52.
Qi S, Pang Y, Hu Q, Liu Q, Li H, Zhou Y, He T, Liang Q, Liu Y, Yuan X, Luo G, Li H, Wang J,Yan N*,Shi Y*. Crystal structure of the Caenorhabditis elegans apoptosome reveals an octameric assembly of CED-4. Cell. 2010;141(3):446-57. (co-corresponding authors)
Wang Y, Huang Y, Wang J, Cheng C, Huang W, Lu P, Xu YN, Wang P, Yan N*, Shi Y*. Structure of the formate transporter FocA reveals a pentameric aquaporin-like channel. Nature. 2009;462(7272):467-72. (co-corresponding authors)
Yin P, Fan H, Hao Q, Yuan X, Wu D, Pang Y, Yan C, Li W, Wang J, Yan N. Structural insights into the mechanism of abscisic acid signaling by PYL proteins. Nat Struct Mol Biol. 2009;16(12):1230-6. Prior to 2007
Yan N, Shi Y. Allosteric activation of a bacterial stress sensor. Cell. 2007;131(3):441-3.
Wu Z*, Yan N*, Feng L*, Oberstein A, Yan H, Baker RP, Gu L, Jeffrey PD, Urban S, Shi Y. Structural analysis of a rhomboid family intramembrane protease reveals a gating mechanism for substrate entry.Nat Struct Mol Biol. 2006;13(12):1084-91.(co-first authors)
Yan N, Huh JR, Schirf V, Demeler B, Hay BA, Shi Y. Structure and activation mechanism of the Drosophila initiator caspase Dronc. J Biol Chem. 2006;281(13):8667-74.
Yan N, Xu Y, Shi Y. 2:1 Stoichiometry of the CED-4-CED-9 complex and the tetrameric CED-4: insights into the regulation of CED-3 activation. Cell Cycle. 2006;5(1):31-4.
Yan N, Shi Y. Mechanisms of apoptosis through structural biology. Annu Rev Cell Dev Biol. 2005; 21:35-56.
Yan N, Chai J, Lee ES, Gu L, Liu Q, He J, Wu JW, Kokel D, Li H, Hao Q, Xue D, Shi Y. Structure of the CED-4-CED-9 complex provides insights into programmed cell death in Caenorhabditis elegans. Nature. 2005; 437(7060):831-7.
Yan N, Gu L, Kokel D, Chai J, Li W, Han A, Chen L, Xue D, Shi Y. Structural, biochemical, and functional analyses of CED-9 recognition by the proapoptotic proteins EGL-1 and CED-4. Mol Cell. 2004; 15(6):999-1006.
Yan N, Wu JW, Chai J, Li W, Shi Y. Molecular mechanisms of DrICE inhibition by DIAP1 and removal of inhibition by Reaper, Hid and Grim. Nat Struct Mol Biol. 2004;11(5):420-8.
Yan N, Shi Y. Histone H1.2 as a trigger for apoptosis. Nat Struct Biol. 2003;10(12):983-5.
Chai J*, Yan N*, Huh JR, Wu JW, Li W, Hay BA, Shi Y. Molecular mechanism of Reaper-Grim-Hid-mediated suppression of DIAP1-dependent Dronc ubiquitination. Nat Struct Biol. 2003;10(11):892-8. (co-first authors)
1.Yan N
2.Yan N*
3.Yan N*
4.Yan N
5.Nieng Yan
6.Nieng Yan
7.Yan N
8.Yan N.
9.Yan N
10.Yan N
11.Yan N
12.Yan N*
13.Yan N*
14.Yan N
15.Yan N,
16.Yan N*
17.Yan N,
18.Yan N
19.Yan N, Shi Y. Mechanisms of apoptosis through structural biology. Annu Rev Cell Dev Biol. 2005; 21:35-56.
20.Yan N,
21.Yan N
22.Yan N,
23.Yan N
24.Yan N*
![顏寧[美國普林斯頓大學教授] 顏寧[美國普林斯頓大學教授]](/img/2/911/nBnauM3XwEzM4YjM5IjM5EDN0UTMyITNykTO0EDMwAjMwUzLyIzLwQzLt92YucmbvRWdo5Cd0FmL0E2LvoDc0RHa.jpg)
