介紹
可分為三類:①鹽皮質激素(mineralocorticoids),由球狀帶分泌,有醛固酮(aldosterone)和去氧皮質酮(desoxycortone, desoxycorticosterone)等。②糖皮質激素(glucocorticoids),由束狀帶合成和分泌,有氫化可的松(hydrocortisone)和可的松(cortisone)等,其分泌和生成受促皮質素(ACTH)調節。③性激素,由網狀帶所分泌,通常所指腎上腺皮質激素,不包括後者。臨床常用的皮質激素是指糖皮質激素
。
化學結構
腎上腺皮質激素的基本結構為甾核,構效關係非常密切:①C3的酮基、C20的羰基及C4-5的雙鍵是保持生理功能所必需;②糖皮質激素的C17上有-OH;C11上有=O或-OH;③鹽皮質激素的C17上無-OH;C11上無=O或有O與C18相聯;④C1~2為雙鍵以及C6引入-CH3則抗炎作用增強、水鹽代謝作用減弱;⑤C9引入-F,C16引入-CH3或-OH則抗炎作用更強、水鹽代謝作用更弱。為了提高皮質激素的臨床療效,曾對它們的結構進行改造並獲得多種新型藥物。
糖皮質激素作用廣泛而複雜,且隨劑量不同而異。生理情況下所分泌的糖皮質激素主要影響物質代謝過程,超生理劑量的糖皮質激素則還有抗炎、抗免疫等藥理作用。具有調節糖、脂肪、和蛋白質的生物合成和代謝的作用,還具有抗炎作用,稱其為“糖皮質激素”是因為其調節糖類代謝的活性最早為人們所認識。
生理效應
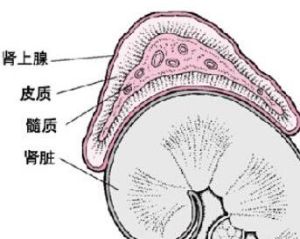
 腎上腺構造
腎上腺構造1.糖代謝糖皮質激素能增加肝糖原、肌糖原含量並升高血糖,其機制為:促進糖原異生;減慢葡萄糖分解為CO2的氧化過程;減少機體組織對葡萄糖的利用。
2.蛋白質代謝促進淋巴和皮膚等的蛋白質分解,抑制蛋白質的合成,久用可致生長減慢、肌肉消瘦、皮膚變薄、骨質疏鬆、淋巴組織萎縮和傷口癒合延緩等。
3.脂肪代謝促進脂肪分解,抑制其合成。久用能增高血膽固醇含量,並激活四肢皮下的脂酶,使四肢脂肪減少,還使脂肪重新分布於面部、胸、背及臀部,形成滿月臉和向心性肥胖。
4.水和電解質代謝也有較弱的鹽皮質激素的作用,能保鈉排鉀。增加腎小球濾過率和拮抗抗利尿素,故可利尿。過多時還可引起低血鈣,長期套用可致骨質脫鈣。
藥理作用
抗炎作用
糖皮質激素有強大的抗炎作用,能對抗各種原因如物理、化學、生理、免疫等所引起的炎症。在炎症早期可減輕滲出、水腫、毛細血管擴張、白細胞浸潤及吞噬反應,從而改善紅、腫、熱、痛等症狀;在後期可抑制毛細血管和纖維母細胞的增生,延緩肉芽組織生成,防止糖連及瘢痕形成,減輕後遺症。但必須注意,炎症反應是機體的一種防禦功能,炎症後期的反應更是組織修復的重要過程。因此,糖皮質激素在抑制炎症、減輕症狀的同時,也降低機體的防禦功能,可致感染擴散、阻礙創口癒合。
皮質激素抗炎作用的基本機制在於糖皮質激素(GCS)與靶細胞漿內的糖皮質激素受體(G-R)相結合後影響了參與炎症的一些基因轉錄而產生抗炎效應。糖皮質激素的靶細胞廣泛分布於肝、肺、腦、骨、胃腸平滑肌、骨骼肌、淋巴組織、成纖維細胞、胸腺等處。各類細胞中受體的密度也各不相同。
G-R由約800個胺基酸構成。其C端與GCS結合;其中央有兩個鋅指(zinc finger),各結合4個半胱氨酸;其N端的功能區τ1涉及與DNA結合後的轉錄性基因轉移活化以及與其他轉錄因子的結合,人的G-R的結合功能區中還有τ2,它對受體進入核內有重要作用。
未活化的G-R與一大分子(約30kDa)蛋白質複合物相結合,該複合物含有兩個熱休克蛋白90(heat shock protein 90,Hsp 90),其C端與受體相結合;該複合物可能還結合有其他蛋白,如抑制性蛋白等。一旦GCS與G-R結合,Hsp 90被解離,則被活化的GCS-G-R複合物迅速進入核內,進而與靶的基因的啟動子(promoter)序列的糖皮質激素反應成分(glucocorticoid response element,GRE)或負性糖皮質激素反應成分(negative glucocorticoid respones element,nGRE)相結合,相應地引起轉錄增加或減少,繼而通過mR-NA影響介質蛋白合成。
GCS可通過增加或減少基因轉錄而抑制炎症過程的某些環節,如對細胞因子、炎症介質及一氧化氮合成酶等的影響等。
細胞因子(cytokine)在慢性炎症起到重要作用。它們能促進血管內皮細胞粘附白細胞,進而使其從血液滲出到炎性部位,並能使內皮細胞、嗜中性白細胞及區噬細胞活化,還能使血管通透性增加、刺激成纖維細胞增生以及刺激淋巴細胞增殖與分化。GCS通過與G-R結合-nGRE的相互作用而抑制了一些與慢性炎症有關的細胞因子白介素1(IL-1)、腫瘤壞死因子α(TNFα)、巨噬細胞集落刺激因子(GM-CSF)、白介素3(IL-3)、白介素4(IL-4)、白介素5(IL-5)、白介素6(IL-6)及白介素8(IL-8)等的轉錄,而強烈地抑制細胞因子介導的炎症。也有證據表明GCS可增加mRNA的斷裂而使IL-1、IL-3及GM-CSF減少。GCS也可通過抑制IL-2受體的合成,或通過將活化轉錄因子活化蛋白-1(activator protein-1,AP-1)等的活化調節逆轉,或通過直接與AP-1相互作用,而對抗細胞因子的效應。
炎症介質,如白三烯(LT)、前列腺素(PG)等,前者有較強的白細胞趨化作用和增加血管通透性的作用,後者可引起紅、腫、熱、痛等炎症反應。GCS可通過增加脂皮素(lipocortin-1)的合成及釋放而抑制脂質介質白三烯(LT)、前列腺素(PG)及血小板活化因子(PAF)的生成,因為脂皮素(37kDa)可抑制脂質生成所必需的磷脂酶A2(PLA2)。皮質激素還可以誘導血管緊張素轉化酶(ACE)而降解緩激肽(可引起血管舒張和致痛),產生抗炎作用。
GCS可抑制巨噬細胞中一氧化氮合酶(NO synthase,NOS)而發揮抗炎作用,因為各種細胞因子均可誘導NOS,使NO生成增多而增加炎性部位的血漿滲出,水腫形成及組織損傷,加重炎症症狀。
免疫抑制
(詳見第五十章)對免疫過程的許多環節均有抑制作用。首先抑制巨噬細胞對抗原的吞噬和處理。其次,對敏感動物由於淋巴細胞的破壞和解體,使血中淋巴細胞迅速減少;糖皮質激素對人也引起暫時性淋巴細胞減少,其原因可能與淋巴細胞移行至血液以外的組織有關,而不是淋巴細胞溶解所致。動物實驗指出,小劑量主要抑制細胞免疫;大劑量則能抑制由B細胞轉化成漿細胞的過程,使抗體生成減少,干擾體液免疫,原因可能與其選擇性地作用於T細胞亞群,特別是增強了T。抑制B細胞的作用有關。但在人體迄未證實糖皮質激素在治療劑量時能抑制抗體產生。
抵抗休克
超大劑量的皮質激素類藥物已廣泛用於各種嚴重休克,特別是中毒性休克的治療,對其評價雖尚有爭論,但一般認為其作用與下列因素有關:①擴張痙攣收縮的血管和加強心臟收縮;②降低血管對某些縮血管活性物質的敏感性,使微循環血流動力學恢復正常,改善休克狀態;③穩定溶酶體膜,減少心肌抑制因子(myocardio-depressant factor,MDF)的形成。④提高機體對細菌內毒素的耐受力。保護動物耐受腦膜炎雙球菌、大腸桿菌等內毒素致死量數倍至數十倍。
其他作用
(1)血液與造血系統皮質激素能刺激骨髓造血機能,使紅細胞和血紅蛋白含量增加,大劑量可使血小板增多並提高纖維蛋白原濃度,縮短凝血時間;促使中性白細胞數增多,但卻降低其遊走、吞噬、消化及糖酵解等功能,因而減弱對炎症區的浸潤與吞噬活動。對淋巴組織也有明顯影響,在腎上腺皮質功能減退者,淋巴組織增生,淋巴細胞增多;而在腎上腺皮質功能亢進者,淋巴細胞減少,淋巴組織萎縮。
(2)中樞神經系統能提高中樞神經系統的興奮性,出現欣快、激動、失眠等,偶可誘發精神失常。大劑量對兒童能致驚厥。
(3)消化系統糖皮質激素能使胃酸和胃蛋白酶分泌增多,提高食慾,促進消化,但大劑量套用可誘發或加重潰瘍病。
體內過程
口服、注射均可吸收。口服可的松或氫化可的松後1~2小時血藥濃度可達高峰。一次給藥作用持續8~12小時。
氫化可的松在血漿中(濃度小於25μg%時)約有90%以上與血漿蛋白結合,其中77%與皮質激素轉運蛋白(transcortin,corticosteroid binding globulin,CBG)結合,CBG在血漿中含量少,雖親和力大(3×10-7mol/L),但結合容量仍小;另有15%與白蛋白結合,其血漿含量高,結合量大。CBG在肝中合成,雌激素可促進其合成,妊娠期間或雌激素治療時,血中CBG濃度增高而游離的氫化可的松減少,但通過反饋調節,可使游離型者恢復正常水平。肝、腎病時CBG合成減少,可使游離型增多。
吸收後,在肝分布較多。主要在肝中代謝,與葡萄糖醛酸或硫酸結合,與未結合部分一起由尿排出。
氫化可的松的血漿t1/2為80~144分鐘,但在2~8小時後仍具有生物活性,劑量大或肝、腎功能不全者可使t1/2延長;甲狀腺功能亢進時,肝滅活皮質激素加速,使t1/2縮短。潑尼松龍因不易被滅活,t1/2可達200分鐘。
可的松和潑尼松在肝內分別轉化為氫化可的松和潑尼松龍而生效,故嚴重肝功能不全的病人只宜套用氫化可的松或潑尼松龍。與肝微粒體酶誘導劑如苯巴比妥、苯妥英鈉等合用時需加大皮質激素的用量。
臨床套用
替代療法
用於急、慢性腎上腺皮質功能減退症(包括腎上腺危象)、腦垂體前葉功能減退及腎上腺次全切除術後作替代療法。
嚴重感染
(1)嚴重急性感染,如中毒性菌痢、暴髮型流行性腦膜炎、中毒性肺炎、重症傷寒、急性粟粒性肺結核、猩紅熱及敗血症等,在套用有效的抗菌藥物治療感染的同時,可用皮質激素作輔助治療,但對其療效尚有不同看法。病毒性感染一般不用激素,因用後可減低機體的防禦能力反使感染擴散而加劇。但對嚴重傳染性肝炎、流行性腮腺炎、麻疹和乙型腦炎等,也有緩解症狀的作用。
(2)防止某些炎症後遺症,如結核性腦膜炎、腦炎、心包炎、風濕性心瓣膜炎、損傷性關節炎、睪丸炎以及燒傷後疤痕攣縮等,早期套用皮質激素可防止後遺症發生。對虹膜炎、角膜炎、視網膜炎和視神經炎等非特異性眼炎,套用後也可迅速消炎止痛、防止角膜混濁和疤痕粘連的發生。
免疫疾病
(1)自身免疫性疾病風濕熱、風濕性心肌炎、風濕性及類風濕性關節炎、全身性紅斑狼瘡、結節性動脈周圍炎、皮肌炎、自身免疫性貧血和腎病綜合徵等套用皮質激素後可緩解症狀。一般採用綜合療法,不宜單用,以免引起不良反應。異體器官移植手術後所產生的排異反應也可套用皮質激素。
(2)過敏性疾病蕁麻疹、枯草熱、血清熱、血管神經性水腫、過敏性鼻炎、支氣管哮喘和過敏性休克等,應以腎上腺受體激動藥和抗組胺藥治療,病情嚴 重或無效時,也可套用皮質激素輔助治療,使能抑制原-杭體反應反致的組織損害和炎症過程。
休克治療
感染中毒性休克時,在有效的抗菌藥物治療下,可及早、短時間突擊使用大劑量皮質激素,見效後即停藥;對過敏性休克,皮質激素為次選藥,可與首選藥腎上腺素合用;對心原性休克,須結合病因治療;對低血容量性休克,在補液補電解質或輸血後效果不佳者,可合用超大劑量的皮質激素。
各血液病
可用於急性淋巴細胞性白血病、再生障礙性貧血、粒細胞減少症、血小板減少症和過敏性紫癜等的治療,但停藥後易復發。
局部套用
對接觸性皮炎、濕疹、肛門瘙癢、牛皮癬等都有療效。宜用氫化可的松、潑尼松龍或氟輕鬆。對天皰瘡及剝脫性皮炎等嚴重病例仍需全身用藥。
不良反應
不良反應
(1)類腎上腺皮質功能亢進綜合徵因物質代謝和水鹽代謝紊亂所致,如滿月臉、水牛背、向心性肥胖、皮膚變薄、痤瘡、多毛、浮腫、低血鉀、高血壓、糖尿等。停藥後可自行消退,必要時採取對症治療,如套用降壓藥、降糖藥、氯化鉀、低鹽、低糖、高蛋白飲食等。
(2)誘發或加重感染因皮質激素抑制機體防禦功能所致。長期套用常可誘發感染或使體內潛在病灶擴散,特別是在原有疾病已使抵抗力降低如腎病綜合徵者更易產生。還可使原來靜止的結核病灶擴散、惡化。故結核病患者必要時應並用抗結核藥。
(3)消化系統併發症使胃酸、胃蛋白酶分泌增加,抑制胃粘液分泌,降低胃腸黏膜的抵抗力,故可誘發或加劇胃、十二指腸潰瘍,甚至造成消化道出血或穿孔。對少數患者可誘發胰腺炎或脂肪肝。
(4)心血管系統併發症長期套用可引起高血壓和動脈粥樣硬化。
(5)骨質疏鬆、肌肉萎縮、傷口癒合遲緩等與激素促進蛋白質分解、抑制其合成及增加鈣、磷排泄有關。骨質疏鬆多見於兒童、老人和絕經婦女,嚴重者可有自發性骨折。因抑制生長素分泌和造成負氮平衡,還可影響生長發育。對孕婦偶可引起畸胎。
(6)其他精神失常。有精神病或癲癇病史者禁用或慎用。
停藥反應
(1)長期套用尤其是連日給藥的病人,減量過快或突然停藥時,由於皮質激素的反饋性抑制腦垂體前葉對ACTH的分泌,可引起腎上腺皮質萎縮和機能不全。多數病人可無表現。腎上腺皮質功能恢復的時間與劑量、用藥期限和個體差異有關。停用激素後垂體分泌ACTH的功能需經3~5個月才恢復;腎上腺皮質對ACTH起反應機能的恢復約需6~9個月或更久。因此不可驟然停藥。停藥後也有少數患者遇到嚴重應激情況如感染、創傷、手術時可發生腎上腺危象,如噁心、嘔吐、乏力、低血壓、休克等,需及時搶救。這種皮質功能不全需半年甚至1~2年才能恢復。
(2)反跳現象因病人對激素產生了依賴性或病情尚未完全控制,突然停藥或減量過快而致原病復發或惡化。常需加大劑量再行治療,待症狀緩解後再逐漸減量、停藥。
禁忌症狀
曾患或現患嚴重精神病和癲癇,活動性消化性潰瘍病,新近胃腸吻合術,骨折,創傷修復期,角膜潰瘍,腎上腺皮質功能亢進症,嚴重高血壓,糖尿病、孕婦,抗菌藥不能控制的感染如水痘、黴菌感染等都是皮質激素的禁忌症。當適應症與禁忌症同時並存時,應全面分析,權衡利弊,慎重決定。一般說,病情危重的適應症,雖有禁忌症存在,仍不得不用,待危急情況過去後,儘早停藥或減量。
用法療程
宜根據病人、病情、藥物的作用和不良反應特點確定製劑、劑量、用藥方法及療程:
大劑量法
用於嚴重中毒性感染及各種休克。氫化可的松首次劑量可靜脈滴注200~300mg,一日量可達1g以上,療程不超過3天。對於休克有人主張用超大劑量,每次靜脈注射1g,一日4~6次。
一般劑量
用於結締組織病、腎病綜合徵、頑固性支氣管哮喘、中心性視網膜炎、各種惡性淋巴瘤、淋巴細胞性白血病等。一般開始時用潑尼鬆口服10~20mg或相應劑量的其他皮質激素製劑,每日3次,產生臨床療效後,逐漸減量至最小維持量,持續數月。
小劑量法
用於垂體前葉功能減退、阿狄森病及腎上腺皮質次全切除術後。一般維持量,可的松每日12.5~25mg,或氫化可的松每日10~20mg。
隔日療法
皮質激素的分泌具有晝夜節律性,每日上午8~10時為分泌高潮(約450nmol/L),隨後逐漸下降(下午4時約110nmol/L),午夜12時為低潮,這是由ACTH晝夜節律所引起。臨床用藥可隨這種節律進行,即長期療法中對某些慢性病採用隔日一次給藥法,將一日或兩日的總藥量在隔日早晨一次給予,此時正值激素正常分泌高峰,對腎上腺皮質功能的抑制較小。實踐證明,外源性皮質激素類藥物對垂體-腎上腺皮質軸的抑制性影響,在早晨最小,午夜抑制最大,隔日服藥以用潑尼松、潑尼松龍等中效製劑較好。
治療方法
腎上腺皮質激素套用於臨床已半個世紀。從我國的調查顯示類風濕關節炎患者過去服用過和(或)仍服用激素的患者,達50%~70%。長期服用數年,甚至達十數年者大有人在。所以有必要進一步提高對皮質激素的認識。 首先,不能認為激素是一"萬能"藥。
1、免疫的抑制作用:人注射激素後,淋巴細胞暫時減少,是由於淋巴細胞再分布的結果。動物實驗中有些顯示免疫抑制作用所需的激素濃度,在人身上不可能達到。激素對體液(抗體)免疫的抑制作用 並非很強。
2、激素的藥理作用因劑量不同而不完全相同。對類風濕關節炎國際上倡導的用小劑量激素,如每日小於7.5mg,其主要作用是抗炎,而非抑制T細胞。 激素 對已形成的關節炎無有效的影響。
3、臨床證實激素長期使用對類風濕關節炎骨質破壞的效果不明顯,而白內障及骨折發生率則明顯增高。結節性多動脈炎及韋格納肉芽腫等,激素也只能起有限的作用,而真正控制病情,明顯提高五年生存率,甚至使某些患者長期緩解或治癒,仍有賴於加用環磷醯胺。對狼瘡腎炎亦相似。細胞毒性免疫抑制劑不只可更好控制病情,且可有助減少繳素的用量。 激素有益的作用受劑量的影響,但激素長期大量使用則有許多副作用。所以激素是一雙刃劍,有利也有弊。
4、小劑量激素的套用 :對小劑量激素短期套用治療類風濕關節炎,作為用慢作用藥未起效前的一個過渡措施,特別是非甾類抗炎藥效果不佳時,不存在爭議,但劑量一般不超過7.5mg,早晨一次服用。但長期小劑量激素即使可減少一些副作用,但白內障、青光眼、糖尿病、痤瘡、多毛、紫癜、皮萎縮、骨脫鈣(以敏感方法檢測)仍可發生。
總上所述,以下原則可為臨床工作者參考:
(1)激素需用大量時,不遲疑地可用大量,如狼瘡腦病。甲潑尼松龍1000mg靜脈衝擊治療亦可。為類風濕關節炎血管炎如下肢潰瘍、快速進展性肺間質纖維化、冠狀動脈炎、"惡性"高熱中毒症狀重……等,主張每日給潑尼松40~120mg,以儘快抑制炎症。
(2)激素不需用大量時,目的性明確即該用小量。例如為類風濕關節炎作為慢作用藥尚未起效前之過渡措施,或非 甾體類抗炎藥療效不滿意時的短期措施,都不需用大量。
(3)激素能短期使用者,儘量不長期使用。例如類風濕關節炎嚴重的關節炎暴發,日用潑尼松60mg亦無不可,但只能短期使用,不宜長期延續。
(4)需激素長期使用者,多數開始用大量,以後漸減量至維持量。病情活動時每日3次服用,病情穩定後宜過渡至每日一次服用,再以後過渡至隔日服用(如潑尼松每日7.5mg維持,過渡至隔日服用15mg),以減少激素的副作用。
(5)需激素長期使用者,應注意是否應與其他藥並用,如狼瘡腎炎、給節性多動脈炎、韋格納肉芽腫、硬皮病、多發性肌炎……都需與細胞毒性免疫抑制藥並用。
(6)類風濕關節炎有主張小量激素長期服用與慢作用藥並用者, 但應權衡利弊。
(7)關節內注射激素可用長效製劑,如己曲安奈德(氟羥強的松龍,triamcinolone bexacetonide)等,但多用於復發時關節炎只限於少數幾個關節時,且注射間隔不宜太近,次數不宜太多。
(8)長期小量激素如用於類風濕關節炎,應給予"建骨"治療,如絕經期和絕經後婦女用雌激素代替治療(用或不用孕激素)。預防措施還包括補鈣(乳酸鈣或葡萄糠酸鈣或拘櫞酸鈣或碳酸鈣,每日1.0g)和補充維生素 D(每周5000IU),骨化三醇(calcitriol)每日 0.5~1.0ug,效果最好,但甚昂貴。
(9)地塞米松較之潑尼松無特別優越性,但似更易發生骨缺血性壞死(有報告短期使用也可發生),不宜廣泛採用。