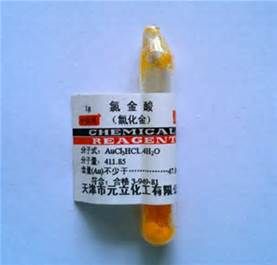
基本介紹
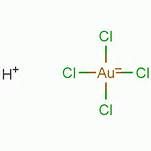 氯金酸分子結構
氯金酸分子結構別名:四氯金酸,四氯合金酸
英文名稱:Chloroauric acid;auric chloride;auric trichloride;gold chloride;gold trichloride;gold chloride;goldchloride;goldtrichloride;Goldchloride
CAS:16961-25-4
分子式:HAuCl4
含結晶水的分子式:AuCl3·HCl·4H2O
分子質量:339.79
理化性質
 氯金酸
氯金酸金溶於王水的方程式:
Au+4HCl+HNO3=HAuCl4+NO+2H2O
在這個反應中,濃鹽酸中的氯離子與金配位結合(4Cl-+Au==(AuCl4)4-),使其更容易被氧化,之後濃硝酸中的N5+將配位後的金氧化成Au3+,而自己被還原成N2+,(N5++(AuCl4)4-==(AuCl4)-+N2+)並放出分子中多餘的O2-。O2-與濃鹽酸中多餘的氫離子結合成H2O,而N2+則以NO的形式放出。
製備方法
 氯金酸
氯金酸反應方程式:
Au+HNO3+4HCl=HAuCl4+NO+2H2O
在這個反應中,濃鹽酸中的氯離子與金配位結合(4Cl-+Au==(AuCl4)4-),使其更容易被氧化,之後濃硝酸中的N5+將配位後的金氧化成Au3+,而自己被還原成N2+,(N5++(AuCl4)4-==(AuCl4)-+N2+)並放出分子中多餘的O2-。O2-與濃鹽酸中多餘的氫離子結合成H2O,而N2+則以NO的形式放出。
三氯化金溶於濃鹽酸得到氯金酸。有研究稱金粉溶於過氧化氫-濃鹽酸也可以安全環保地製備氯金酸。
反應方程式:
AuCl3+HCl=HAuCl4
用途介紹
氯金酸水溶液中含有正方平面的[AuCl4]-離子,由此可以製得許多含有平面正方形離子[AuX4]-的鹽(X=F,Cl,Br,I,CN,SCN,NO3)。
可用於半導體及積體電路引線框架局部鍍金,印刷電路板、電子接外掛程式及其他電接觸元件的鍍金。也可製作紅色玻璃。用作分析試劑,專用於銣、銫的微量分析和測量生物鹼組成等。還用於照像材料。
AuCl3 + 4KCN → KAu(CN)4 + 3KCl 氯金酸鹽,特別是氯金酸鈉NaAuCl4 (由 AuCl3與NaCl反應製得),可取代有毒的汞(II)鹽作為炔烴反應的催化劑。例如,通過終端炔烴的水合作用來製備甲基酮:
氯金酸鹽,特別是氯金酸鈉NaAuCl4(由AuCl3與NaCl反應製得),可取代有毒的汞(II)鹽作為炔烴反應的催化劑。
同時,氯金酸作為製備納米級金方面有著重要套用,一般通過還原劑直接還原氯金酸制的具有螢光效應的納米金,在分析化學中有著重要套用。